题目内容
【题目】下列说法不正确的是( )
A.纯净的水晶是由硅原子和氧原子构成的,每个原子的最外层均具有8电子稳定结构
B.Na2O是由离子构成的,其溶于水形成溶液的过程中既有离子键、共价键的断裂又有共价键的形成
C.现代科技已经能够拍到氢键的“照片”,直观地证实了水分子间的氢键是一个水分子中的氢原子与另一个水分子中的氧原子间形成的化学键
D.NH5中所有原子的最外层都符合相应的稀有气体原子的最外层电子结构,是既含有离子键又含有共价键的离子化合物
【答案】C
【解析】
A.水晶的主要成分是![]() ,是由硅原子和氧原子构成的,
,是由硅原子和氧原子构成的,![]() 晶体中1个硅原子与4个氧原子形成共价键,1个氧原子与2个硅原子形成共价键,每个原子的最外层都具有8电子稳定结构,A正确;
晶体中1个硅原子与4个氧原子形成共价键,1个氧原子与2个硅原子形成共价键,每个原子的最外层都具有8电子稳定结构,A正确;
B.![]() 是离子化合物,溶于水生成NaOH的过程中,水中H-O键断裂,Na2O中离子键断裂,生成NaOH时有H—O共价键形成,B正确;
是离子化合物,溶于水生成NaOH的过程中,水中H-O键断裂,Na2O中离子键断裂,生成NaOH时有H—O共价键形成,B正确;
C.氢键是分子间作用力,不属于化学键,C错误;
D.![]() 中所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则其化学式可能为
中所有原子的最外层都符合相应稀有气体原子的最外电子层结构,则其化学式可能为![]() ,是一种铵盐,铵盐中既有离子键又有共价键,属于离子化合物,D正确;
,是一种铵盐,铵盐中既有离子键又有共价键,属于离子化合物,D正确;
故选C。

【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。反应原理如下:
电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l)
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. AB. BC. CD. D
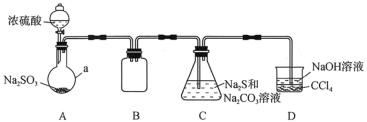
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |