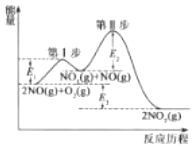
题目内容
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
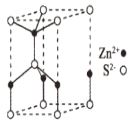
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)
【答案】![]() 球形 Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低
球形 Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低 ![]() 16 ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高 ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌 4
16 ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高 ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌 4 ![]() ×100%
×100%
【解析】
(1)对于主族元素来说,价电子就是最外层电子,但对于Zn来说,它是副族(ⅡB),其价电子还与3d能级上的电子有关;当电子排布完成后,4s能级上的电子能量最高,4s能级电子云是球形;
(2)Zn与Ga在周期表中虽然是相邻元素,但价电子不一样,Zn的价电子排布式是3d104s2,而Ga的价电子排布式为4s24p1,结合洪特规则判断;
(3)①CN-与N2、CO是等电子体,它们的结构相似,其中N2的结构式为![]() ;
;
②双键碳和双键氮以及苯环碳均是sp2杂化;
(4)ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,而ZnF2属于离子晶体,它们的熔沸点由于晶体类型不同,影响它们熔沸点的作用力不同,应区别对待;
(5)这种ZnS晶胞不属于立方晶胞,上下两个底面是平行四边形,两个角呈120°、另两个角呈60°,这就决定了处于晶胞顶点上的8个S2-,有4个被12个晶胞共用,另4个被6个晶胞共用;处于棱上的4个Zn2+,有2个被6个晶胞共用、另2个被3个晶胞共用,这样就可以求出晶胞的组成。再根据密度与质量、体积的关系以及球的体积公式即可求得离子占晶胞体积的百分率。
(1)Zn的原子序数为30,其价电子排布式为3d104s2,价层电子轨道表达式为:![]() ;占据最高能层的电子处于4s能级上,所以是球形;
;占据最高能层的电子处于4s能级上,所以是球形;
(2)第一电离能是从气态基态原子中去掉一个电子所需的能量,Zn的价电子排布式是3d104s2,4s能级上电子处于全充满状态,较稳定,难以失去电子;而镓(31Ga)的价电子排布式为4s24p1,容易失去4p能级上的一个电子,故Ga的第一电离能比Zn的低;
(3)①CN-与N2互为等电子体,等电子体具有相似的结构。N2的结构式为![]() ,故CN-的电子式为
,故CN-的电子式为![]() ;
;
②每个二苯硫腙分子中,2个苯环的12个碳原子为sp2杂化,形成双键的硫原子、碳原子和2个氮原子也为sp2杂化,共计16个;
(4)①分子晶体熔沸点由分子间作用力大小决定,ZnCl2、ZnBr2、ZnI2均为分子晶体且结构相似,相对分子质量依次增大,分子间作用力逐渐增强,故熔点依次升高;
②晶体的熔沸点决定于晶体类型,一般来说熔沸点是:原子晶体>离子晶体>分子晶体,ZnF2属于离子晶体,熔化时需要破坏离子键,而其它三种晶体属于分子晶体,离子键的强度大于分子间作用力,故其熔点远高于其它三种卤化锌;
(5)①由晶胞结构可知,每个Zn2+周围连有4个O2-,配位数为4;
②该一个晶胞中含有S2-的数目为:![]() ×4+
×4+![]() ×4+1=2;含Zn2+的数目为:
×4+1=2;含Zn2+的数目为:![]() ×2+
×2+![]() ×2+1=2。即一个晶胞中含有2个ZnS,根据密度与质量、体积的关系可以求出一个晶胞的体积,即:d=
×2+1=2。即一个晶胞中含有2个ZnS,根据密度与质量、体积的关系可以求出一个晶胞的体积,即:d=![]() cm3,S2-、Zn2+可以看做刚性球,球的体积公式是
cm3,S2-、Zn2+可以看做刚性球,球的体积公式是![]()
![]() r3,故该晶胞中离子的体积占晶胞体积的百分率为:
r3,故该晶胞中离子的体积占晶胞体积的百分率为: ×100%=
×100%=![]() ×100%。
×100%。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案