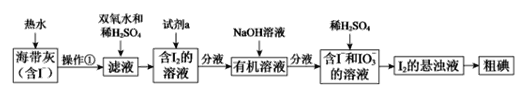
【题目】CO2回收与利用是环境科学家研究的热点课题。利用CO2制备合成气(CO、H2),再制备高值产品,如甲醇等,也可以利用CO2直接制备甲醇等产品。
(1)已知几种反应的正反应活化能(E1)、逆反应活化能(E2)如表所示:
序号 | 化学反应 | E1/(kJ·mol-1) | E2/(kJ·mol-1) |
① | 2CO(g)+O2(g)===2CO2(g) | 1954 | 2519 |
② | H2(g)+ | 685 | 970 |
③ | 2CH3OH(g)+3O2(g)===2CO2(g)+4H2O(l) | 3526 | 4978 |
在相同条件下,起始反应最快的是____(填序号)。由H2和CO合成气态甲醇的热化学方程式为________。
(2)T1℃下,在2L恒容密闭容器中充入0.20mol CO和0.60mol H2合成CH3OH,发生反应:CO(g)+2H2(g)![]() CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
CH3OH(g) △H<0,经5min恰好达到平衡,CH3OH的浓度是0.05mol·L-1。
①T1℃时,以H2表示的反应的平均速率为___,平衡常数K=____。
②(T1+100)℃时,在1L恒容密闭容器中充入0.10molCO、0.20molH2和0.30mol CH3OH,此时反应将____(填“向左移动”“向右移动”“达到平衡”或“无法判断”)。
(3)CO2和H2在催化剂作用下反应,可以直接合成甲醇:CO(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
CH3OH(g)+H2O(g) △H<0,测得相同时间内甲醇产率与温度的关系如图所示。
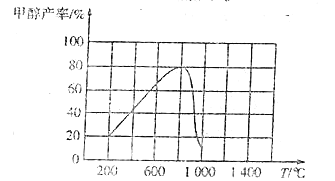
①温度在800℃时甲醇产率最高的主要原因是/span>____。
②下列措施能提高CO2平衡转化率的是____(填字母)。
A.升温 B.加压 C.加入催化剂 D.增大H2浓度
(4)利用电解法在酸性条件下将CO2和H2O转化或CO和H2,阴极反应式之一为CO2+2e-+2H+=CO+H2O,其机理如下:①CO2+2e-+H2O===CO+2OH-(慢反应);②OH-+CO2=HCO3-(快反应);③HCO3-+H+=CO2+H2O(快反应)。其中水的作用是___;控制阴板反应速率的反应是___(填序号)。