题目内容
【题目】侯氏制碱法又称联合制碱法,是我国化学工程专家侯德榜于1943年发明的。此方法具有食盐利用率高、对环境的污染少、生产成本低等优点。其制备中涉及如下两个反应:NaC1+H2O+CO2+NH3===NaHCO3↓+NH4Cl、2NaHCO3![]() Na2CO3+CO2↑+H2O。
Na2CO3+CO2↑+H2O。
(1)基态氯原子的电子排布式为___,基态氮原子最高能级上电子自旋方向均相同,这是由____规则(原理)确定的,C、N、O三种元素第一电离能由大到小的顺序为____。
(2)H2O、CO2、NH3三种分子中,中心原子的杂化轨道类型为sp的是___,属于V形分子的是____。在常温常压下,1体积水可溶解700体积NH3、可溶解0.8体积CO2,试解释其原因:_____。
(3)要确定Na2CO3固体是晶体还是非晶体,最可靠的方法是___,下列事实不能支持Na2CO3的晶体类型为离子晶体的是___(填字母)。
a.熔点为851℃ b.晶体中存在Na+、CO32-
c.可溶于水 d.晶体中存在离子键,共价键
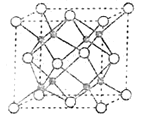
(4)钠、氧两元素可形成两种常见化合物,其中一种的晶胞如下图所示(图中微粒表示相应的结构微粒),则该氧化物的化学式为___,若晶胞参数为d pm,晶胞的密度为![]() ,则阿伏加德罗常数NA=___(用含d、
,则阿伏加德罗常数NA=___(用含d、![]() 的代数式表示)。
的代数式表示)。
【答案】1s22s22p63s23p5或[Ne]3s23p5 洪特 N>O>C CO2 H2O CO2是非极性分子而水是极性分子,故CO2在水中溶解度较小,NH3是极性分子且能与水分子形成分子间氢键,故NH3在水中溶解度很大 X-射线衍射法 c Na2O ![]()
【解析】
(1)核外电子排布满足能量最低原理、泡利不相容原理;N原子2p轨道上的电子处于半充满状态,第一电离能大于O;
(2)根据价电子对数判断中心原子的杂化轨道类型;利用价电子互斥理论判断分子空间构型。分子间形成氢键可以增大溶解度,极性分子易溶于极性溶剂;
(3)X-射线衍射法可以判断晶体和非晶体;溶解性与晶体类型无关。
(1)氯原子核外有17个电子,根据能量最低原理,基态氯原子的电子排布式为1s22s22p63s23p5,电子在同一能级上自旋方向相同是由洪特规则确定的。N原子2p轨道上的电子处于半充满状态,第一电离能大于O,元素的第一电离能由大到小的顺序为N>O>C。
(2)H2O、CO2、NH3三种分子中,中心原子的价层电子对数分别为![]() 4个、
4个、![]() 2个、
2个、![]() 4个,故中心原子杂化轨道类型分别为sp3、sp、sp3。水分子是V形分子。NH3可与水分子间形成氢键,从而使其溶解度很大;CO2是非极性分子而水是极性分子,故CO2在水中溶解度小。
4个,故中心原子杂化轨道类型分别为sp3、sp、sp3。水分子是V形分子。NH3可与水分子间形成氢键,从而使其溶解度很大;CO2是非极性分子而水是极性分子,故CO2在水中溶解度小。
(3)判断固体是晶体还是非晶体最可靠的方法是X-射线衍射法。离子晶体熔点较高,由离子构成,含有离子键,由于许多分子晶体也可溶于水,故c项符合题意。
(4)由图及均摊原理知,晶胞中氧离子数是![]() 、钠离子的数目是8,故化学式为Na2O,一个晶胞中含有4个“Na2O”组成微粒,晶胞的体积为d3
、钠离子的数目是8,故化学式为Na2O,一个晶胞中含有4个“Na2O”组成微粒,晶胞的体积为d3![]() 10-30 cm3,晶胞的质量为
10-30 cm3,晶胞的质量为![]() ,
,![]() ,
,![]() 。
。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案