题目内容
【题目】常温下,将Na2A和NaHA溶液分别进行稀释,若-lg c(Na+)=pNa、-lgc(OH-)=pOH,则测得两种溶液中pNa与pOH的关系曲线如图。下列说法正确的是( )
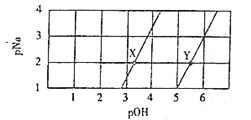
A. X点所在的直线表示NaHA溶液的稀释
B. 在Y点加入适量NaOH固体可以达到X点
C. 将X和Y点溶液等体积混合,则有c(Na+)>c(A2-)>c(HA-)>c(OH-)>c(H+)
D. 常温下,H2A的Ka1数量级为10-5
【答案】D
【解析】
A、浓度相同的Na2A和NaHA溶液中,NaHA的水解程度小,溶液碱性弱,故Y点所在的直线表示NaHA溶液的稀释,A项错误;
B、X点和Y点处pNa相同,即c(Na+)相同,在Y点加入适量NaOH固体,c(Na+)增大,故不可能达到X点,B项错误;
C、pNa=2时,c(Na+)=10-2mol·L-1,故X点Na2A的浓度为0.5×10-2mol·L-1,Y点NaHA的浓度为l×10-2mol·L-1,A2-水解程度强于HA-,故c(HA-)>c(A2-),C项错误;
D、根据Y点所在曲线,pNa=1,pOH=5,可知c(Na+)=10-1mol·L-1(近似为NaHA的浓度),c(OH-)=10-5mol·L-1,根据HA-+H2O![]() H2A+OH-,则HA-的水解常数Kh=
H2A+OH-,则HA-的水解常数Kh=![]() ,则H2A的电离常数
,则H2A的电离常数![]() ,可知数量级为10-5,D项正确。
,可知数量级为10-5,D项正确。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目