题目内容
【题目】海洋是一个巨大的资源宝库。在海洋中生长的海带,富含碘元素。某同学设计以下实验方案,从海带中提取I2。
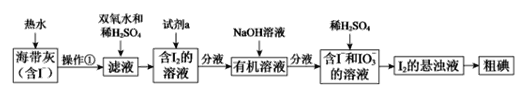
(1)灼烧海带时,除需酒精灯与三脚架外,还需要用到的实验仪器是___。
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是__________。
(3)试剂a可以是_________(填序号)。
A 酒精 B 四氯化碳
C 裂化汽油 D 苯
(4)I-和IO3-在酸性条件下生成I2的离子方程式是__________。
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是_________。
【答案】坩埚、泥三角 2I-+ H2O2 + 2H+ = I2 + 2H2O BD 5I-+IO3-+6H+ = 3I2 + 3H2O 富集碘元素
【解析】
(1)灼烧需要坩埚、泥三角、三角架、酒精灯、坩埚钳;
(2)滤液中含有碘离子加入双氧水和稀硫酸反应生成碘单质和水;
(3)试剂a是从I2的水溶液中分离得到I2,操作为萃取,萃取剂选择时应选择与原试剂互不相溶,且I2在萃取剂中的溶解度比在水中大,以此分析;
(4)I-和IO3-在酸性条件下生成I2和水,根据电子守恒、电荷守恒及原子守恒配平方程;
(5)上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是提高I2的浓度,达到富集碘元素的目的。
(1)灼烧需要坩埚、泥三角、三角架、酒精灯、坩埚钳,则步骤①灼烧海带时,除需要酒精灯与三脚架外,还需要用到的实验仪器是坩埚、泥三角;故答案为坩埚、泥三角;
(2)向滤液中加入双氧水和稀硫酸发生反应的离子方程式是2I-+ H2O2 + 2H+ = I2 + 2H2O,故答案为:2I-+ H2O2 + 2H+ = I2 + 2H2O;
(3)试剂a是从I2的水溶液中分离得到I2可以根据I2容易溶于有机溶剂苯、四氯化碳中溶解度大而在水中溶解度较小,苯或四氯化碳与水互不相溶,且与I2不反应的性质,通过萃取分离得到,因此可以是四氯化碳、苯,而不能使用与水互溶的或容易溶于水的乙醇、乙酸;故答案为:BD。
(4) I-和IO3-在酸性条件下生成I2和水,根据电子守恒、电荷守恒及原子守恒,可得反应的离子方程式是5I-+IO3-+6H+ = 3I2 + 3H2O。故答案为:5I-+IO3-+6H+ = 3I2 + 3H2O。
(5) 上图中,含I2的溶液经3步转化为I2的悬浊液,其目的是提高I2的浓度,达到富集碘元素的目的。故答案为:富集碘元素