【题目】硫及其化合物有许多用途,相关物质的物理常数如下表所示:
H2S | S8 | FeS2 | SO2 | SO3 | H2SO4 | |
熔点/℃ | 85.5 | 115.2 | >600(分解) | 75.5 | 16.8 | 10.3 |
沸点/℃ | 60.3 | 444.6 | 10.0 | 45.0 | 337.0 |
回答下列问题:
(1)基态Fe原子价层电子排布式为__________,基态S原子电子占据最高能级的电子云轮廓图为_________形,共有______能量不同的原子轨道;
(2)根据价层电子对互斥理论,H2S、SO2、SO3的气态分子中,中心原子价层电子对数不同于其他分子的是_________。

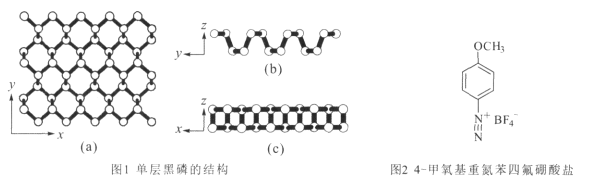
(3)图(a)为S8的结构,其熔点和沸点要比二氧化硫的熔点和沸点高很多,主要原因为_______。
(4)气态H2S的分子的立体构型为_____形,固体三氧化硫中存在如图(b)所示的三聚分子,该分子中S原子的杂化轨道类型为________。
(5)FeS2晶体的晶胞如图(c)所示。晶胞边长为a nm、FeS2相对式量为M,阿伏加德罗常数的值为NA,其晶体密度的计算表达式为___________g·cm3。
【题目】25 ℃时,部分物质的电离常数如表所示:
化学式 | CH3COOH | H2CO3 |
电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 |
请回答下列问题:
(1)相同pH的CH3COONa、NaHCO3、Na2CO3浓度由大到小的顺序为__________
(2)常温下0.1mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(H+)/c(OH-)
(3)现有10mLpH=2的盐酸溶液,进行以下操作:
a.与pH=5的盐酸等体积混合,则pH=_____________;
b.向该盐酸溶液中加入10mL0.02mol/LCH3COONa溶液,则该混合溶液中存在的物料守恒式为__________________;
c.向该盐酸溶液中加入等体积等浓度的Na2CO3溶液,则混合溶液中存在的电荷守恒式为_______________________;
d. 下列关于体积都为10mL,pH=2的A(盐酸)和B(CH3COOH)溶液说法正确的是_____ (填写序号)。
①与等量的锌反应开始反应时的速率A=B
②与等量的锌反应(锌完全溶解,没有剩余)所需要的时间A>B
③加水稀释100倍,pH大小比较:4=A>B>2
④物质的量浓度大小比较:A>B
⑤分别与10mLpH=12的NaOH溶液充分反应后的溶液pH大小比较:A<B
e. 现用标准HCl溶液滴定氨水,应选用________指示剂,下列操作会导致测定结果偏高的是___。
A.未用HCl标准溶液润洗滴定管
B.滴定前锥形瓶内有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.观察读数时,滴定前仰视,滴定后俯视
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g) = 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为_____
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)。下列叙述能说明此反应达到平衡状态的是________。
A.混合气体的平均摩尔质量保持不变B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)改变温度,使反应CO2(g) + 3H2(g)CH3OH(g) + H2O(g)△H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
恒温恒容 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
反应I | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡时CH3OH的浓度c(I)___________c(II)。(填“>”“<”或“=”,下同);将反应I的条件改为绝热恒容,平衡时的平衡常数与反应I的比较_________(填“增大”“减小”或“不变”)
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=________ ,在其他条件不变下,将温度改为T2,测得30min时,H2的物质的量为3.2mol,则T1____T2(填“>”“<”或“=”)若30min时只向容器中再冲入1molCO2(g)和1molH2O(g),则平衡_______移动(填“正向”、“逆向”或“不”)
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①甲烷燃料电池的负极反应式: ____________________________________
②电解后溶液的pH= __________________________(忽略氯气与氢氧化钠溶液反应)。