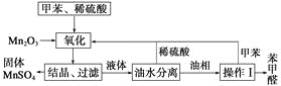
题目内容
【题目】(1)铅蓄电池(原电池)工作时,总反应为Pb +PbO2+2H2SO4→2PbSO4 +2H2O 由此可以判断:
A.原电池的电极材料:①正极为____,②负极为___。
B.工作后,蓄电池里电解质溶液的pH___(填“变大”“变小”或“不变”),理由是____。
(2)如图所示,水槽中试管内有一枚铁钉,放置数天观察:

a.若试管内液面上升,则原溶液是___性,发生_____腐蚀,电极反应,正极为_____。
b.若试管内液面下降,则原溶液呈____性,发生____腐蚀,电极反应:负极为____。
【答案】PbO2 Pb 变大 H2SO4被消耗,酸性减弱 弱酸性或中 吸氧 O2+4e-+2H2O=4OH- 较强的酸 析氢 Fe - 2e-=Fe2+
【解析】
(1)根据Pb +PbO2+2H2SO4→2PbSO4 +2H2O,结合元素化合价变化分析解答;
(2)生铁中含有碳,铁、碳和合适的电解质溶液构成原电池,在弱酸性或中性条件下,铁发生吸氧腐蚀,在酸性条件下,铁发生析氢腐蚀,据此分析解答。
(1)A.电池反应Pb +PbO2+2H2SO4→2PbSO4 +2H2O中Pb元素化合价由0价、+4价变为+2价,根据元素化合价变化知,PbO2得电子发生还原反应作正极,Pb失电子发生氧化反应作负极,故答案为:PbO2;Pb;
B.根据电池反应Pb +PbO2+2H2SO4→2PbSO4 +2H2O知,放电过程中硫酸参加反应,所以随着反应的进行,氢离子浓度减小,所以溶液的pH变大,故答案为:变大;H2SO4被消耗,酸性减弱;
(2)a.若试管内液面上升,说明试管中氧气被消耗,则钢铁发生吸氧腐蚀,溶液呈中性或弱酸性,Fe易失电子作负极、C作正极,负极上铁失电子生成亚铁离子,电极反应式为Fe-2e-=Fe2+,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,故答案为:弱酸性或中性;吸氧;O2+2H2O+4e-=4OH-;
b.若试管内液面下降,说明有气体生成,则钢铁发生析氢腐蚀,溶液呈酸性,负极上铁失电子发生亚铁离子,电极反应式为Fe-2e-=Fe2+,故答案为:酸;析氢;Fe-2e-=Fe2+。