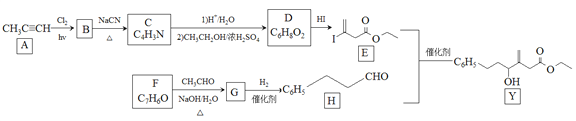
题目内容
【题目】工业燃烧煤、石油等化石燃料释放出大量氮氧化物(NOx)、CO2、CO、SO2等气体,严重污染空气。对废气进行脱硝、脱碳和脱硫处理可实现绿色环保、废物利用。
I.脱硝:已知:H2的热值为142.9 kJ/g(热值是表示单位质量的燃料完全燃烧时所放出的热量);
N2(g) + 2O2(g) = 2NO2(g) △H= +133 kJ/mol
H2O(g) =H2O(l) △H=- 44 kJ/mol
催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为_____
Ⅱ.脱碳:
(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应:
CO2(g)+3H2(g)CH3OH(l)+H2O(l)。下列叙述能说明此反应达到平衡状态的是________。
A.混合气体的平均摩尔质量保持不变B.CO2和H2的体积分数保持不变
C.CO2和H2的转化率相等 D.混合气体的密度保持不变
E.1 mol CO2生成的同时有3 mol H—H键断裂
(2)改变温度,使反应CO2(g) + 3H2(g)CH3OH(g) + H2O(g)△H<0中的所有物质都为气态,起始温度体积相同(T1℃、2L密闭容器)。反应过程中部分数据见下表:
恒温恒容 | 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) |
反应I | 0 min | 2 | 6 | 0 | 0 |
10 min | 4.5 | ||||
20 min | 1 | ||||
30 min | 1 | ||||
反应II | 0 min | 0 | 0 | 2 | 2 |
①达到平衡时,反应I、II对比:平衡时CH3OH的浓度c(I)___________c(II)。(填“>”“<”或“=”,下同);将反应I的条件改为绝热恒容,平衡时的平衡常数与反应I的比较_________(填“增大”“减小”或“不变”)
②对反应Ⅰ,前10min内的平均反应速率v(CH3OH)=________ ,在其他条件不变下,将温度改为T2,测得30min时,H2的物质的量为3.2mol,则T1____T2(填“>”“<”或“=”)若30min时只向容器中再冲入1molCO2(g)和1molH2O(g),则平衡_______移动(填“正向”、“逆向”或“不”)
(3)甲烷燃料电池可以提升能量利用率。下图是利用甲烷燃料电池电解100mL 1mol·L -1食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变)。

①甲烷燃料电池的负极反应式: ____________________________________
②电解后溶液的pH= __________________________(忽略氯气与氢氧化钠溶液反应)。
【答案】4H2(g)+2NO2(g)==N2(g)+4H2O(g) △H= -1100.2 kJ/mol DE = 减小 0.025mol/(L.min) < 不 CH4+2H2O-8e-=CO2+8H+ 14
【解析】
Ⅰ、依据题意书写出氢气燃烧的热化学方程式,再根据盖斯定律处理得到目标热化学方程式;
Ⅱ、(1)平衡标志是正逆反应速率相等,各组分含量保持不变,据此分析各选项;
(2)①CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H<0,反应Ⅰ中2mol CO2、6mol H2和反应Ⅱ中2mol CH3OH(g)、2mol H2O(g)等效;将反应I的条件改为绝热恒容,反应后温度升高,结合温度对平衡的影响分析判断;
②反应速率v=![]() 计算得到氢气反应速率,再根据速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量,结合平衡的影响因素分析判断;
计算得到氢气反应速率,再根据速率之比等于化学方程式计量数之比计算甲醇反应速率;依据平衡三段式列式计算分析平衡状态的物质的量,结合平衡的影响因素分析判断;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+;
②根据氯化钠的物质的量及电解方程式来求溶液中生成的氢氧根离子浓度,再计算出溶液的pH。
Ⅰ. 已知:H2的热值为142.9kJg-1 ,则燃烧热为285.8kJ/mol,因此①H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ/mol,②N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol,③H2O(g)=H2O(l) △H=-44 kJ/mol,根据盖斯定律,将①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJmol-1,故答案为:4H2(g)+2NO2(g) = N2(g)+4H2O(g) △H=-1100.2kJmol-1;
O2(g)=H2O(l) △H=-285.8kJ/mol,②N2(g)+2O2(g)=2NO2(g) △H=+133 kJ/mol,③H2O(g)=H2O(l) △H=-44 kJ/mol,根据盖斯定律,将①×4-②-③×4得到催化剂存在下,H2还原NO2生成水蒸气和N2的热化学方程式为4H2(g)+2NO2(g)=N2(g)+4H2O(g)△H=-1100.2kJmol-1,故答案为:4H2(g)+2NO2(g) = N2(g)+4H2O(g) △H=-1100.2kJmol-1;
Ⅱ.(1)向2L恒容密闭容器中加入2 mol CO2、6 mol H2,在适当的催化剂作用下,发生反应CO2(g)+3H2(g)![]() CH3OH(l)+H2O(l)。A、混合气体的平均摩尔质量始终保持不变,不能说明反应达到平衡状态,故A错误; B、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,由于生成物不是气体,所以过程中CO2和H2的体积分数始终保持不变,不能说明反应达到平衡状态,故B错误;C、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故C错误;D、反应物是气体,生成物是液体,反应过程中气体的质量减小而体积不变,故混合气体的密度是变量,当混合气体的密度保持不变时,能够说明反应达到平衡状态,故D正确;E、1mol CO2生成的同时有3mol H-H键断裂,说明正、逆反应速率相同,反应达到平衡状态,故E正确;故答案为:DE;
CH3OH(l)+H2O(l)。A、混合气体的平均摩尔质量始终保持不变,不能说明反应达到平衡状态,故A错误; B、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,由于生成物不是气体,所以过程中CO2和H2的体积分数始终保持不变,不能说明反应达到平衡状态,故B错误;C、向2L密闭容器中加入2mol CO2、6mol H2,按照1∶3反应,CO2和H2的转化率始终相等,不能确定反应是否达到平衡状态,故C错误;D、反应物是气体,生成物是液体,反应过程中气体的质量减小而体积不变,故混合气体的密度是变量,当混合气体的密度保持不变时,能够说明反应达到平衡状态,故D正确;E、1mol CO2生成的同时有3mol H-H键断裂,说明正、逆反应速率相同,反应达到平衡状态,故E正确;故答案为:DE;
(2)①根据反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H<0,反应Ⅰ中2mol CO2、6mol H2和反应Ⅱ中2mol CH3OH(g)、2mol H2O(g)等效,平衡时达到相同的平衡状态,即CH3OH的浓度c(I)= c(II);将反应I的条件改为绝热恒容,反应后温度升高,相当于反应I在恒温恒容容器中达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故答案为:=;减小;
CH3OH(g)+H2O(g)△H<0,反应Ⅰ中2mol CO2、6mol H2和反应Ⅱ中2mol CH3OH(g)、2mol H2O(g)等效,平衡时达到相同的平衡状态,即CH3OH的浓度c(I)= c(II);将反应I的条件改为绝热恒容,反应后温度升高,相当于反应I在恒温恒容容器中达到平衡后,升高温度,平衡逆向移动,平衡常数减小,故答案为:=;减小;
② CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始量(mol) 2 6 0 0
变化量(mol) 1 3 1 1
30min量(mol) 1 3 1 1
对反应I,前10min内的平均反应速率v(CH3OH)=![]() v(H2)=
v(H2)=![]() ×(6-4.5)mol2L10min =0.025molL-1min-1;若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,氢气增加,说明平衡逆向移动,温度升高,即T2>T1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),对正逆反应的影响程度相同,平衡不移动,故答案为:0.025molL-1min-1 ;<;不;
×(6-4.5)mol2L10min =0.025molL-1min-1;若30min时只改变温度为T2℃,此时H2的物质的量为3.2mol,氢气增加,说明平衡逆向移动,温度升高,即T2>T1,若30min时只向容器中再充入1mol CO2(g)和1mol H2O(g),对正逆反应的影响程度相同,平衡不移动,故答案为:0.025molL-1min-1 ;<;不;
(3)①原电池负极发生氧化反应,甲烷在负极通入,酸性条件下,发生氧化反应生成CO2、H+,负极的电极反应式为:CH4-8e-+2H2O=CO2+8H+,故答案为:CH4-8e-+2H2O=CO2+8H+;
②标况下2.24L氢气的物质的量为0.1mol,100mL 1mol/L食盐水中含有氯化钠0.1mol,根据反应方程式2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑可知,电解0.1molNaCl生成0.1mol氢氧化钠和0.05mol氢气,同时生成0.05mol氯气,因此需要继续电解水,即氯化钠完全电解。因此电解生成标况下2.24L氢气时,生成氢氧化钠的物质的量为:0.1mol,此时溶液中氢氧根离子浓度为:
2NaOH+H2↑+Cl2↑可知,电解0.1molNaCl生成0.1mol氢氧化钠和0.05mol氢气,同时生成0.05mol氯气,因此需要继续电解水,即氯化钠完全电解。因此电解生成标况下2.24L氢气时,生成氢氧化钠的物质的量为:0.1mol,此时溶液中氢氧根离子浓度为:![]() =1mol/L,溶液中氢离子浓度为:c(H+)=
=1mol/L,溶液中氢离子浓度为:c(H+)=![]() mol/L =10-14mol/L,所以溶液的pH=14,故答案为:14。
mol/L =10-14mol/L,所以溶液的pH=14,故答案为:14。

【题目】一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷萃取及蒸馏等步骤。已知:
Br2 | CCl4 | 正十二烷 | |
密度/g·cm-3 | 3.119 | 1.595 | 0.753 |
沸点/℃ | 58.76 | 76.8 | 215~217 |

下列说法正确的是( )
A. 用甲装置过滤时,需不断搅拌
B. 用乙装置将Br-氧化为Br2
C. 丙装置中用正十二烷而不用CCl4,是因为其密度小
D. 可用装置丁进行蒸馏,先收集正十二烷再收集Br2