【题目】探究2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+10CO2↑+8H2O反应速率的影响因素,有关实验数据如下表所示:下列说法不正确的是( )
实验编号 | 温度 | 催化剂用量(g) | 酸性KMnO4溶液 | H2C2O4溶液 | KMnO4溶液褪色平均时间 min | ||
体积(mL) | 浓度mol·L-1 | 体积(mL) | 浓度 mol·L-1 | ||||
1 | 25 | 0.5 | 4 | 0.1 | 8 | 0.2 | 12.7 |
2 | 80 | 0.5 | 4 | 0.1 | 8 | 0.2 | a |
3 | 25 | 0.5 | 4 | 0.01 | 8 | 0.2 | 6.7 |
4 | 25 | 0 | 4 | 0.01 | 8 | 0.2 | b |
A. a<12.7,b>6.7
B. 用KMnO4表示该反应速率,v(实验3)<v(实验1)
C. 用H2C2O4表示该反应速率,v(实验1)约为7.87×10-5 mol·L-1·min-1
D. 可通过比较收集相同体积CO2所消耗的时间来判断反应速率快慢
【题目】碳、氮广泛分布在自然界中,碳、氮的化合物性能优良,在工业生产和科技领域有重要用途。
(1)氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300~1700oC的氮气流中反应制得:3SiO2(s) + 6C(s) + 2N2(g)![]() Si3N4(s) + 6CO(g) ΔH=-1591.2 kJ/mol则该反应每转移1mol e-,可放出的热量为________
Si3N4(s) + 6CO(g) ΔH=-1591.2 kJ/mol则该反应每转移1mol e-,可放出的热量为________
(2)高温时,用CO还原MgSO4可制备高纯MgO
①750℃时,测得气体中含等物质的量的SO2和SO3,此时反应的化学方程式是:____________
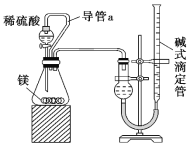
②由MgO制成的Mg可构成“镁—次氯酸盐”电池,其装置示意图如图,该电池的正极反应式为____________

(3)某研究小组将三组CO(g)与H2O(g)的混合气体分别通入体积为2L的恒容密闭容器中,一定条件下发生反应:CO(g) + H2O(g)![]() CO2(g) + H2(g),得到如下数据:
CO2(g) + H2(g),得到如下数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达平衡所需时间/min | ||
CO | H2O | CO | H2 | |||
1 | 650 | 2 | 4 | 0.5 | 1.5 | 5 |
2 | 900 | 1 | 2 | 0.5 | 0.5 | — |
①实验Ⅰ中,前5min的反应速率v(CO2)=___________
②下列能判断实验Ⅱ已经达到平衡状态的是(填写选项序号)__________
a.容器内CO、H2O、CO2、H2的浓度不再变化
b.容器内压强不再变化
c.混合气体的密度保持不变
d.v正(CO)=v逆(CO2)
e.容器中气体的平均相对分子质量不随时间而变化
③若实验Ⅲ的容器是绝热的密闭容器,实验测得H2O(g)的转化率H2O%随时间变化的示意图如下图所示,b点v正_______v逆(填“<”、“=”或“>”),t3~t4时刻,H2O(g)的转化率H2O%降低的原因是______________________

【题目】一定温度下,在三个体积约为1.0L的恒容密闭容器中发生反应:2CH3OH(g)![]() CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
容器 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
I | 387 | 0.20 | 0.080 | 0.080 |
Ⅱ | 387 | 0.40 | ||
Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
下列说法正确的是
A.该反应的正方应为放热反应
B.达到平衡时,容器I中的CH3OH体积分数比容器Ⅱ中的小
C.容器I中反应达到平衡所需时间比容器Ⅲ中的长
D.若起始时向容器I中充入CH3OH 0.1mol、CH3OCH3 0.15mol和H2O 0.10mol,则反应将向正反应方向进行