【题目】某同学用某种粗盐进行提纯实验,步骤如下图所示。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是__________________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了防止________________,当蒸发皿中有较多量固体出现时,应________,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用内壁涂有澄清石灰水的小烧杯罩住试管口 | ________ | 猜想Ⅰ 成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴加________,再滴加Na2SO4溶液 | 有气泡冒出,无白色沉淀 | ________ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体于试管中溶解,________ | ________ | 猜想Ⅲ 成立 |
【题目】用中和滴定法测定某烧碱的纯度。将2.5g含有少量杂质(不与盐酸反应)的固体烧碱样品配制成250mL溶液。根据实验回答下列问题:
(1)滴定
①用____________(仪器)量取20.00mL待测液置于锥形瓶中,再滴加2滴酚酞试液。
②用____________(仪器)盛装0.2000 mol·L-1盐酸标准液,盛装前务必____________,防止标准液浓度降低。
③滴定过程中眼睛应注视_______________,滴定终点的现象为:_______________________________________________________。
(2)有关数据记录如下:
滴定序号 | 待测液体体积(mL) | 滴定前(mL) | 滴定后(mL) | 所消耗盐酸标准液的平均体积(mL) |
1 | 20.00 | 0.50 | 20.70 | V |
2 | 20.00 | 6.00 | 26.00 |
计算V=________ml
(3)纯度计算:NaOH溶液的浓度为________ mol·L-1,烧碱样品的纯度为________。
(4)试判断以下几种情况对烧碱纯度测定的影响(填“偏大”、“偏小”或“无影响”):
①若用蒸馏水冲洗锥形瓶,则会使测定结果________;
②若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则会使测定结果________;
③若刚见到指示剂局部的颜色有变化就停止滴定,则会使测定结果________;
④读数时,若滴定前仰视,滴定后俯视,则会使测定结果________。
【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),
CO(g)+H2O(g),
其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K =_______________。
(2)该反应为_______________反应(填“吸热”、“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是_______________。
a.容器中压强不变 b.混合气体中c(CO)不变
c.v正(H2)=v逆(H2O) d.c(CO2)=c(CO)
(4)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为_______________℃。
(5)1200℃时,在某时刻体系中CO2、H2、CO、H2O的浓度分别为2mol·L-1、2mol·L-1、4mol·L-1、4mol·L-1,则此时上述反应的平衡向__________移动(填“正向”、“逆向”或“不”)。
【题目】氮的固定是几百年来科学家一直研究的课题。请回答下列问题:
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值。
反应 | 大气固氮 N2 (g)+O2 (g) | 工业固氮 N2 (g)+3H2 (g) | |||
温度/℃ | 27 | 2000 | 25 | 400 | 450 |
K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
①分析数据可知:大气固氮反应属于 ________(填“吸热”或“放热”)反应。
②分析数据可知:人类不适合大规模模拟大气固氮的原因是 ________。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因 ________。
(2)已知工业固氮反应:N2(g)+ 3H2(g)![]() 2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
2NH3(g)ΔH =-94.4kJ·mol-1,恒容时,体系中各物质浓度随时间变化的曲线如图1所示,各时间段最终均达平衡状态。
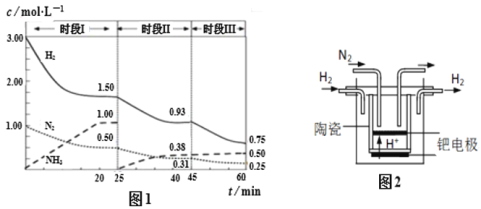
①在2L容器中发生反应,前20min内,ν(NH3) = ________。
②25 min时采取的某种措施是 ________。
③时段III条件下反应的平衡常数为 ________ L2· mol-2(保留3位有效数字) 。
(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电解法合成氨,提高了反应物的转化率,其实验简图如图2所示,阴极的电极反应式是 ________。
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)
4NH3(g)+3O2(g),则其反应热ΔH = ________。已知:N2(g)+ 3H2(g)![]() 2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)
2NH3(g) ΔH1 =-92.4kJ·mol-1 2H2(g) +O2(g)![]() 2H2O(l) ΔH2 =-571.6kJ·mol-1
2H2O(l) ΔH2 =-571.6kJ·mol-1