题目内容
【题目】NaAlH4(四氢铝钠)是有机合成的重要还原剂。某小组以铝合金厂的废边脚料为原料(主要成分为Al,含有少量Al2O3、Fe2O3,MgO和SiO2、等杂质制备四氢铝钠的工艺流程如下:

资料显示:NaH、NaAlH4遇水蒸气发生剧烈反应。
请回答下列问题:
(1) NaAlH4中氢元素的化合价为___________。
(2)试剂A中溶质的阴、阳离子所含电子数相等,其电子式为___________。在空气中灼烧滤渣2,得到的固体的主要成分为___________(填化学式)。
(3)滤液3可以循环利用,写出滤液2与滤液3反应的离子方程式:___________。
(4)实验前要保证NaH与AlC13反应的装置干燥,其目的是___________________。
(5)已知废料接触面积、接触时间均相同,“酸浸”中铝元素浸出率与硫酸浓度的关系如图所示。当硫酸浓度大于 C0 mol·L-1时,浸出率降低的原因可能是___________。

(6)测定NaAlH4粗产品的纯度。
称取 m g NaAlH4粗产品按如图所示装置进行实验,测定产品的纯度。
①“安全漏斗”中“安全”的含义是____________________________________________。
②已知实验前B管读数为xmL,向A中加入足量蒸馏水,当A中反应完全后,冷却至室温B管读数为ymL(均折合成标准状况)。则该产品的纯度为___________(用含m、x和y的代数式表示)。
③若实验前读数时B管和C管液面相平,实验后读数时B管液面低于C管,则测得的结果___________(填“偏高”“偏低”或“无影响”)
【答案】-1价 ![]() Fe2O3、MgO AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- 防止NaH、NaAlH4与水蒸气反应 硫酸浓度增大,铝片与硫酸发生钝化 加入液体能起液封作用,避免气体从漏斗中逸出
Fe2O3、MgO AlO2-+HCO3-+H2O=Al(OH)3↓+CO32- 防止NaH、NaAlH4与水蒸气反应 硫酸浓度增大,铝片与硫酸发生钝化 加入液体能起液封作用,避免气体从漏斗中逸出 ![]() 偏低
偏低
【解析】
(1)根据化合物中各元素化合价代数和为0进行计算;
(2)试剂A为强碱,将铝元素转化成偏铝酸盐,由于试剂A中溶质的阴离了和阳离子所含电子数相等,则试剂A为氢氧化钠。滤渣1的主要成分是二氧化硅,滤渣2的主要成分是氢氧化铁和氢氧化镁。在空气中灼烧生成氧化铁、氧化镁;
(3)偏铝酸钠和碳酸氢钠反应类似于较强酸制备较弱酸;
(4)NaH、NaAlH4均能够与水蒸气反应;
(5)浓硫酸与铝片发生纯化,反应减慢;
(6)①“安全"的含义是避免气体逸出。从安全漏斗的结构看出,上部液体不能完全滴入烧瓶,起到了液封作用;
②根据反应NaAlH4+H2O=NaAlO2+4H2↑进行求算;
读数时C管液面高于B管,存在液压差,导致测得的H2的体积(y)偏小,使结果偏低。
(1) NaAlH4中钠元素为+1价,铝元素为+3价,根据化合物中各元素化合价代数和为0,则氢元素的化合价为-1价;
(2)试剂A为强碱,将铝元素转化成偏铝酸盐,由于试剂A中溶质的阴离了和阳离子所含电子数相等,则试剂A为氢氧化钠。其电子式为![]() ;
;
滤渣1的主要成分是二氧化硅,滤渣2的主要成分是氢氧化铁和氢氧化镁。在空气中灼烧生成Fe2O3、MgO;
(3)偏铝酸钠和碳酸氢钠反应类似于较强酸制备较弱酸,滤液2与滤液3反应的离子方程式为AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-;
(4)NaH、NaAlH4均能够与水蒸气反应,实验前要保证NaH与AlC13反应的装置干燥,其目的是防止NaH、NaAlH4与水蒸气反应;
(5)浓硫酸与铝片发生纯化,反应减慢,浸出率降低;
(6)①“安全"的含义是避免气体逸出。从安全漏斗的结构看出,上部液体不能完全滴入烧瓶,起到了液封作用,避免气体逸出;
②NaAlH4+H2O=NaAlO2+4H2↑
n(H2)=![]() ,n(NaAlH4)=
,n(NaAlH4)=![]() ,
,
![]() (NaAlH4)=
(NaAlH4)=![]() 。若反应完后,读数时C管液面高于B管,存在液压差,导致测得的H2的体积(y)偏小,使结果偏低。
。若反应完后,读数时C管液面高于B管,存在液压差,导致测得的H2的体积(y)偏小,使结果偏低。

【题目】氧化亚氮(N2O)是一种强温室气体,且易转换成颗粒污染物。研究氧化亚氮分解对环境保护有重要意义。
(1)污水生物脱氮过程中,在异养微生物催化下,硝酸铵可分解为N2O和另一种产物,该反应的化学方程式为________。
(2)已知反应2N2O(g)=2N2(g) + O2(g)的ΔH= –163 kJ·mol-1,1molN2(g)、1molO2(g)分子中化学键断裂时分别需要吸收945 kJ、498 kJ的能量,则1molN2O(g)分子中化学键断裂时需要吸收的能量为________ kJ。
(3)在一定温度下的恒容容器中,反应2N2O(g)=2N2(g) + O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
C(N2O)/mol/L | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.010 |
①在0~20min时段,反应速率v(N2O)为________ mol·L-1·min-1。
②若N2O起始浓度c0为0.150 mol·L-1,则反应至30min时N2O的转化率α =__________。比较不同起始浓度时N2O的分解速率:v(c0=0.150 mol·L-1) ________ v(c0=0.100 mol·L-1)(填“>”、“=”或“<”)。
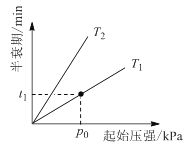
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O消耗一半时所需的相应时间),则T1________T2(填“>”、“=”或“<”)。当温度为T1、起始压强为p0,反应至t1 min时,体系压强p =________(用p0表示)。
(4)碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步 I2(g) ![]() 2I(g) (快反应)
2I(g) (快反应)
第二步 I(g)+N2O(g)→N2(g)+IO(g) (慢反应)
第三步 IO(g)+N2O(g)→N2(g)+O2(g)+I(g) (快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是________(填标号)。
A.N2O分解反应中,k(含碘)> k(无碘) B.第一步对总反应速率起决定作用
C.第二步活化能比第三步大 D.I2浓度与N2O分解速率无关
【题目】(1)CO2经过催化氢化合成低碳烯烃.其合成乙烯的反应为2CO2(g)+6H2(g)![]() CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
CH2=CH2(g)+4H2O(g)△H,已知几种化学键键能如下表所示:(CO2的结构式:O=C=O)
物质 | H-H | C=O | C=C | C-H | H-O |
能量/kJmol-1 | 436 | 745 | 615 | 413 | 463 |
则△H=_____________________。
(2)工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如下图所示,其中阴极和阳极均为惰性电极。测得同温同压下,气体甲与气体乙的体积比约为2:1。

①气体甲的化学式____________ 。
②a极与电源的____________ (填“正极”或“负极”)相连,该电极反应式为_______________。
③离子交换膜d为________(填“阴离子”或“阳离子”)交换膜。
④产物丙为_________ 溶液。