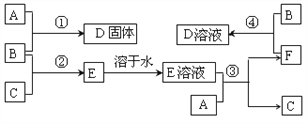
【题目】(l)将Cl2通入水中,Cl2部分与水反应:Cl2+H2O=H++Cl-+HClO。若要减少Cl2的溶解,可在氯水中加入少量________。
a.AgNO3晶体 b. CaCO3粉末 c. NaCl晶体 d.蒸馏水 e.浓盐酸
(2)在一定条件下,同时加入CO、H2O(g)、CO2、H2于一密闭容器中发生如下反应:CO +H2O(g)![]() CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
CO2+H2,反应开始时向右进行。下列说法中不正确的是__________。
a.反应开始时,正反应速率大于逆反应速率
b.反应开始时,正反应速率最大,逆反应速率为零
c.随着反应的进行,正反应速率逐渐减小,最后为零
d.随着反应的进行,逆反应速率增大,正反应速率减小,最后相等。
(3)一定条件下(温度值定), SO2与O2反应的浓度随时间的变化如下表
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
c(SO2)mol/L | 1.0 | |||||||
c(O2)mol/L | 0.5 | 0.35 | 0.25 | 0.18 | 0.1 | 0.05 | 0.05 | 0.05 |
C(SO3)mol/L | 0 | 0.3 | 0.5 | 0.65 | 0.8 | 0.9 | 0.9 | 0.9 |
由上表数据计算:
a.30min-40min 时间段,以SO2表示的反应速率为__________;
b.该温度下,正反应的平衡常数的值为__________________;
c.平衡时,SO2的转化率为_______;
(4)电解尿素[CO(NH3)2]的碱性溶液制氢气的装置示意图见下图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极)。电解时,阳极的电极反应式为____________。

(5)3.04g铜镁合金完全溶解于100mL密度为1.40g/mL、质量分数为63%的硝酸中,得到NO2气体2688mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到5.08g沉淀。则加入NaOH溶液的体积是_________mL。