题目内容
【题目】海洋是生命的摇篮,海水不仅是宝贵的水资源,而且蕴藏着丰富的化学资源。从海水中提取一些重要的化工产品的工艺流程如图所示。
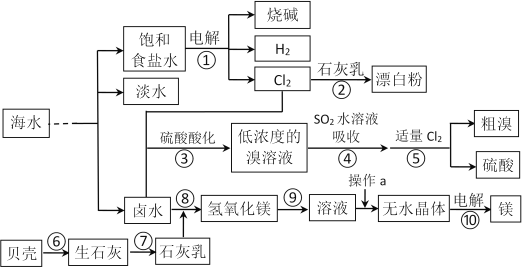
根据上述流程图回答下列问题:
(1)海水淡化处理的方法有蒸馏法、冷冻法、_____________。(写出1种即可)
(2)写出反应①化学反应方程式_______________________________________。
(3)标准状况下22.4 L Cl2气体发生反应②,转移的电子数是________NA。
(4)反应③中硫酸酸化可提高Cl2的利用率,理由是____________________________。
(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是_______________。
(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是__________________________________________。
【答案】 离子交换膜法(也可写成电渗析法或反渗析法) 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 1 酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
2NaOH+H2↑+Cl2↑ 1 酸化可抑制氯气、溴与水反应 富集溴 将MgCl2溶液在HCl气流中蒸干
【解析】(1)海水淡化处理的方法有蒸馏法、冷冻法、离子交换膜法、电渗析法或反渗析法等;(2)反应①是电解饱和食盐水生成氢氧化钠、氢气和氯气,其反应化学反应方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;(3)标准状况下22.4 L Cl2气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。
2NaOH+H2↑+Cl2↑;(3)标准状况下22.4 L Cl2气体发生反应②:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,转移的电子数是NA;(4)反应③中硫酸酸化,抑制氯气、溴与水反应,可提高Cl2的利用率;(5)过程③到过程⑤的变化为“Br-→Br2→Br-→Br2”,其目的是:富集溴;(6)浓缩氯化镁溶液后冷却可以得到MgCl2﹒6H2O,该晶体受热时会发生如下变化:MgCl2﹒6H2O== Mg(OH)Cl + HCl↑+ 5H2O。则,从溶液制备无水晶体的“操作a”可以采取的措施是:将MgCl2溶液在HCl气流中蒸干,避免氯化镁水解而得不到无水晶体。

 阅读快车系列答案
阅读快车系列答案