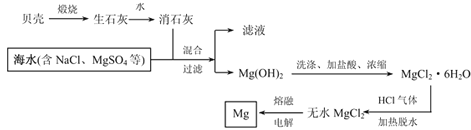
题目内容
【题目】若1.8g 某金属与足量的盐酸反应后,产生的H2在标准状况下体积为2.24L,则该金属为
A. Al B. Mg C. Fe D. Zn
【答案】A
【解析】设金属在化合物中的化合价为x,金属的摩尔质量为M,
酸足量时生成的标准状况下的氢气体积为2.24L,则其物质的量为![]() =0.1mol,由电子守恒可知,
=0.1mol,由电子守恒可知, ![]() ×(x-0)=0.1mol×2×(1-0),即9x=M;A.铝的摩尔质量为27g/mol,在化合物中的化合价为+3价,符合9x=M,故A正确;B.镁的摩尔质量为24g/mol,在化合物中的化合价为+2价,不符合9x=M,故B错误;C.铁的摩尔质量为56g/mol,与盐酸反应后生成的化合物中的化合价为+2价,不符合9x=M,故C错误;D.锌的摩尔质量为65g/mol,在化合物中的化合价为+2价,不符合9x=M,故D错误;故选A。
×(x-0)=0.1mol×2×(1-0),即9x=M;A.铝的摩尔质量为27g/mol,在化合物中的化合价为+3价,符合9x=M,故A正确;B.镁的摩尔质量为24g/mol,在化合物中的化合价为+2价,不符合9x=M,故B错误;C.铁的摩尔质量为56g/mol,与盐酸反应后生成的化合物中的化合价为+2价,不符合9x=M,故C错误;D.锌的摩尔质量为65g/mol,在化合物中的化合价为+2价,不符合9x=M,故D错误;故选A。

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目