题目内容
【题目】镁被称为“国防金属”,镁及其合金用途很广,目前世界上60%的镁从海水中提取。从海水中提取镁的流程如下:
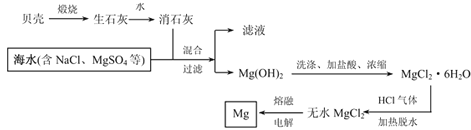
请根据上述流程图和镁及化合物的性质回答下列问题:
(1)用贝壳煅烧生石灰的反应方程式:________________
(2)氢氧化镁溶于盐酸的离子方程式为:_____________。
(3)简述,由MgCl2·6H2O制无水MgCl2,加热时通HCl气体的主要原因是:___________。
(4)金属镁属于(填写下列编号):___________。
a.黑色金属 b.有色金属 c.轻金属 d.重金属 e.贵金属
(5)Mg(OH)2煅烧可得熔点很高的MgO,MgO的电子式为:____________。
(6)MgCl2和AlCl3的熔点均较低,加MgO和Al2O3的熔点都很高。为什么冶炼金属镁是电解MgCl2,而冶炼金属铝则电解Al2O3:_______________。
(7)某MgCl2溶液的浓度为0.01mol/L,在该溶液中滴加NaOH溶液至pH=10,此时溶液中的Mg2+是否沉淀完全?_________(填“是”或“否”),此时c(Mg2+)=_________。
(已知:Ksp[Mg(OH)2]=1.8×10-11)
【答案】 CaCO3![]() CaO+CO2↑ Mg(OH)2+2H+=Mg2++2H2O 抑制MgCl2水解 b、c
CaO+CO2↑ Mg(OH)2+2H+=Mg2++2H2O 抑制MgCl2水解 b、c ![]() MgO和MgCl2均为离子化合物,熔融时均能电解制镁,但MgO熔点很高,电解时能耗高,所以冶炼镁是电解MgCl2,而AlCl3是共价化合物,液态时难导电,所以工业上是电解熔融Al2O3冶炼铝。 否 1.8×10-3mol/L
MgO和MgCl2均为离子化合物,熔融时均能电解制镁,但MgO熔点很高,电解时能耗高,所以冶炼镁是电解MgCl2,而AlCl3是共价化合物,液态时难导电,所以工业上是电解熔融Al2O3冶炼铝。 否 1.8×10-3mol/L
【解析】本题考查化学工艺流程,涉及化学反应原理,(1)贝壳的成分是CaCO3,受热易分解成CaO和CO2,化学反应方程式为CaCO3 ![]() CaO+CO2↑;(2)氢氧化镁属于碱,与盐酸发生复分解反应,Mg(OH)2+2H+=Mg2++2H2O;(3)Mg2+水解的方程式为Mg2++2H2O
CaO+CO2↑;(2)氢氧化镁属于碱,与盐酸发生复分解反应,Mg(OH)2+2H+=Mg2++2H2O;(3)Mg2+水解的方程式为Mg2++2H2O ![]() Mg(OH)2+2H+,因此为了抑制Mg2+水解,因此加热MgCl2·2H2O制取无水MgCl2,需要在HCl气体氛围中进行;(4)a、黑色金属指的是铁、铬、锰三种元素,故a错误;b、有色金属指铁、铬、锰以外的金属单质,故b正确;c、轻金属常指铍、铝、镁、钠、钾、钙、锶等,金属镁属于轻金属,故c正确;d、金属镁不属于重金属,故d错误;e、金属镁不属于贵重金属,故e错误;(5)MgO是离子化合物,即电子式为:
Mg(OH)2+2H+,因此为了抑制Mg2+水解,因此加热MgCl2·2H2O制取无水MgCl2,需要在HCl气体氛围中进行;(4)a、黑色金属指的是铁、铬、锰三种元素,故a错误;b、有色金属指铁、铬、锰以外的金属单质,故b正确;c、轻金属常指铍、铝、镁、钠、钾、钙、锶等,金属镁属于轻金属,故c正确;d、金属镁不属于重金属,故d错误;e、金属镁不属于贵重金属,故e错误;(5)MgO是离子化合物,即电子式为:![]() ;(6)MgO和MgCl2均为离子化合物,熔融时均能电解制镁,但MgO熔点很高,电解时能耗高,所以冶炼镁是电解MgCl2,而AlCl3是共价化合物,液态时难导电,所以工业上是电解熔融Al2O3冶炼铝;(7)溶液中c(OH-)=Kw/c(H+)=10-14/10-10mol·L-1=10-4mol·L-1,此时的c(Mg2+)=Ksp[Mg(OH)2]/c2(OH-)=1.8×10-11/(10-4)2mol·L-1=1.8×10-3mol·L-1>10-5,因此Mg2+没有完全沉淀。
;(6)MgO和MgCl2均为离子化合物,熔融时均能电解制镁,但MgO熔点很高,电解时能耗高,所以冶炼镁是电解MgCl2,而AlCl3是共价化合物,液态时难导电,所以工业上是电解熔融Al2O3冶炼铝;(7)溶液中c(OH-)=Kw/c(H+)=10-14/10-10mol·L-1=10-4mol·L-1,此时的c(Mg2+)=Ksp[Mg(OH)2]/c2(OH-)=1.8×10-11/(10-4)2mol·L-1=1.8×10-3mol·L-1>10-5,因此Mg2+没有完全沉淀。

 阅读快车系列答案
阅读快车系列答案【题目】某学生用已知物质的量浓度的盐酸来测定未知物质的量浓度的NaOH溶液时,选择甲基橙作指示剂。请填写下列空白:
(1)用标准的盐酸滴定待测的NaOH溶液时,左手握酸式滴定管的活塞,右手摇动锥形瓶,眼睛注视________,直到因加入一滴盐酸后,溶液由黄色变为橙色,并___________为止。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是________(填序号)。
A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸
B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净后没有干燥
C.酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
(3)若滴定开始和结束时,酸式滴定管中的液面如右图所示,所用盐酸溶液的体积为________mL。
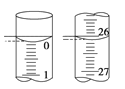
(4)某学生根据3次实验分别记录有关数据如下表:
滴定次数 | 待测NaOH溶液的体积/mL | 0.100 0 mol·L-1盐酸的体积/mL | ||
滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
依据上表数据列式计算该NaOH溶液的物质的量浓度________________。
