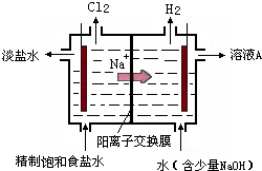
题目内容
100mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,通电一段时间后,两极均收集到4.48L气体(标准状况),假定电解后溶液体积仍为100mL,下列说法不正确的是( )
| A、原混合溶液中c(K+)=1 mol/L |
| B、上述电解过程中一共转移电子0.8 mol |
| C、电解得到的铜的物质的量为0.2 mol |
| D、电解后溶液中c(H+)=2 mol/L |
考点:电解原理
专题:电化学专题
分析:石墨作电极电解此溶液,当通电一段时间后,两极均收集到4.48L气体(标准状况),则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)=
=0.2mol,结合电子守恒及物质的量浓度的计算来解答.
| 4.48L |
| 22.4L/mol |
解答:
解:石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L气体(标准状况),n(O2)=
=0.2mol,
阳极发生4OH--4e-═O2↑+2H2O,
0.8mol 0.2mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
0.2mol 0.4mol 0.2mol 0.4mol 0.2mol
A.c(Cu2+)=
=2mol/L,由电荷守恒可知,原混合溶液中c(K+)为6mol/L-2mol/L×2=2mol/L,故A错误;
B.根据氧气计算转移电子的物质的量,转移电子的物质的量=0.2mol×4=0.8mol,故B正确;
C.电解得到的Cu的物质的量为0.2mol,故C正确;
D.电解后溶液中c(H+)为
=4mol/L,故D错误;
故选AD.
| 4.48L |
| 22.4L/mol |
阳极发生4OH--4e-═O2↑+2H2O,
0.8mol 0.2mol
阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,
0.2mol 0.4mol 0.2mol 0.4mol 0.2mol
A.c(Cu2+)=
| 0.2mol |
| 0.1L |
B.根据氧气计算转移电子的物质的量,转移电子的物质的量=0.2mol×4=0.8mol,故B正确;
C.电解得到的Cu的物质的量为0.2mol,故C正确;
D.电解后溶液中c(H+)为
| 0.8mol-0.4mol |
| 0.1L |
故选AD.
点评:本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等,难点是D,注意氢氧根离子与氢离子的关系即可解答.

练习册系列答案
相关题目
当碳、氢、氧、氮等元素的相对原子量均取整数时,下列说法正确的是( )
| A、烃及烃的含氧衍生物的相对分子量均为奇数 |
| B、硝基化合物的相对分子量均是偶数 |
| C、烃及烃的含氧衍生物的相对分子量均为偶数 |
| D、酚、醛、氨基酸、酯的相对分子量均为偶数 |
由两金属组成的合金19克,与标况下11.2升氯气恰好完全反应,那么此合金可能是( )
| A、钠和铁 | B、铝和铁 |
| C、铜和钠 | D、银和钠 |
将0.3mol NaCl和0.1mol H2SO4溶于一定量的水中配成溶液,用石墨作电极电解该溶液时,根据电极产物,可分为三个阶段,下列说法正确的是( )
①阴极始终只析出H2
②第一阶段相当于电解NaCl溶液
③第一阶段相当于电解HCl溶液
④第二阶段相当于电解NaCl溶液
⑤第二阶段相当于电解HCl溶液
⑥第三阶段相当于电解Na2SO4溶液.
①阴极始终只析出H2
②第一阶段相当于电解NaCl溶液
③第一阶段相当于电解HCl溶液
④第二阶段相当于电解NaCl溶液
⑤第二阶段相当于电解HCl溶液
⑥第三阶段相当于电解Na2SO4溶液.
| A、①③④⑥ | B、①②④ |
| C、①②④⑥ | D、②④⑤⑥ |
用铂作电极电解某种溶液,通电一段时间,溶液的pH变小,并且在阳极得到0.56L气体,阴极得到1.12L气体(两种气体均在相同条件下测定).由此可知溶液可能是( )
| A、稀盐酸 |
| B、KNO3溶液 |
| C、CuSO4溶液 |
| D、稀硫酸 |
用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
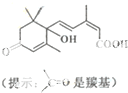 北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )
北京奥运会期间对大量盆栽鲜花施用了S-诱抗素制剂,以保持鲜花盛开.S-诱抗素的分子结构如图,下列关于该分子说法正确的是( )| A、1 mol S-诱抗素的分子能与2molNaOH反应 |
| B、能发生加成、取代、消去反应 |
| C、S-诱抗素的分子式为C14H19O4 |
| D、含有碳碳双键、苯环、羟基、羰基、羧基 |