题目内容
9.环己酮是一种重要的有机化工原料.实验室合成环己酮的反应如下: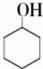 $→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$
$→_{Na_{2}Cr_{2}O_{7}+H_{2}SO_{4}}^{55℃~69℃}$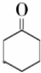
环己醇和环己酮的部分物理性质见下表:
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3,20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
分离提纯过程中涉及到的主要步骤有(未排序):
a.蒸馏,除去乙醚后,收集151℃~156℃馏分;
b.水层用乙醚(乙醚沸点34.6℃,易燃烧)萃取,萃取液并入有机层;
c.过滤;
d.往液体中加入NaCl固体至饱和,静置,分液;
e.加入无水MgSO4固体,除去有机物中少量水.
回答下列问题:
(1)上述分离提纯步骤的正确顺序是d b e c a(填字母).
(2)b中水层用乙醚萃取的目的是使水层中少量的有机物进一步被提取,提高产品的产量.
(3)以下关于萃取分液操作的叙述中,正确的是③.
①振荡几次后需打开分液漏斗上口的玻璃塞放气
②经几次振荡并放气后,手持分液漏斗静置待液体分层
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗口上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体
(4)在上述操作d中,加入NaCl固体的作用是降低环己酮的溶解度,增加水层的密度,有利于分层.蒸馏除乙醚的操作中采用的加热方式为水浴加热.
(5)蒸馏操作时,一段时间后发现未通冷凝水,应采取的正确方法是停止加热,冷却后通自来水.
(6)恢复至室温时,分离得到纯产品体积为 12mL,则环己酮的产率约是60%.
分析 (1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,将水与有机物更容易分离开来,然后向有机层中加入无水MgSO4,出去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,从而提高产品产量;
(3)①放气的方法为:漏斗倒置,打开旋塞放气;
②经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层;
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,再打开旋塞待下层液体全部流尽时,再从上口倒出上层液体;
(4)NaCl能增加水层的密度,降低环己酮的溶解,有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高;
(5)为防止冷凝管炸裂,应该停止加热;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,据此计算产率.
解答 解:(1)环己酮的提纯时应首先加入NaCl固体,使水溶液的密度增大,水与有机物更容易分离开,然后向有机层中加入无水MgSO4,除去有机物中少量的水,然后过滤,除去硫酸镁晶体,再进行蒸馏即可,故答案为:d b e c a;
(2)环己酮在乙醚中的溶解度大于在水中的溶解度,且乙醚和水不互溶,则乙醚能作萃取剂,能将水中的环己酮萃取到乙醚中,从而提高产品产量,
故答案为:使水层中少量的有机物进一步被提取,提高产品的产量;
(3)①放气的方法为:漏斗倒置,打开旋塞放气,而不是打开玻璃塞,故错误;
②经几次振摇并放气后,分液漏斗放置在铁架台上静置待液体分层,而不是手持分漏斗静置液体分层,不符合操作规范性,故错误;
③分液时,需先将上口玻璃塞打开或玻璃塞上的凹槽对准漏斗上的小孔,利用压强差使液体流出,再打开旋塞待下层液体全部流尽时,为防止产生杂质,再从上口倒出上层液体,故正确;
故选③;
(4)NaCl能增加水层的密度,降低环己酮的溶解,且有利于分层;乙醚的沸点较低,所以蒸馏时温度不宜太高,所以应该采用水浴加热,
故答案为:降低环己酮的溶解度,增加水层的密度,有利于分层;水浴加热;
(5)如果直接将冷水连接冷凝管,馏分温度如果急剧冷却会导致冷凝管炸裂,为防止冷凝管炸裂,应该停止加热,冷却后通自来水,
故答案为:停止加热,冷却后通自来水;
(6)m(环己酮)=12mL×0.9478g=11.3736g,根据环己醇和环己酮的关系式知,参加反应的m(环己醇)=$\frac{11.3736g}{98g/mol}$=11.6057g,m(环己醇)=20mL×0.9624g/mL=19.248g,其产率=$\frac{11.6057g}{19.248g}$×100%≈60%,
故答案为:60%.
点评 本题考查制备实验方案设计,涉及物质的分离提纯、基本实验操作、基本计算等知识点,明确实验原理是解本题关键,同时考查学生获取信息、利用信息解答问题能力,易错点是(3)中基本操作方法,题目难度中等.

| A. | NH4+、Ba2+、Cl-、NO3- | B. | K+、Na+、Cl-、SO42- | ||
| C. | Ca2+、Mg2+、NO3-、HCO3- | D. | Na+、Cl-、CO32-、SO32- |

①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O
CCl3CHO+HClO→CCl3COOH+HCl
(三氯乙酸)
②相关物质的相对分子质量及部分物理性质:
| C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
| 相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
| 熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
| 沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
| 溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 | 微溶于水,可溶于乙醇 |
(2)若撤去装置C,可能导致装置D中副产物CCl3COOH、C2H5Cl(填化学式)的量增加;装置D可采用水浴加热的方法以控制反应温度在70℃左右.
(3)反应结束后,有人提出先将D中的混合物冷却到室温,再用过滤的方法分离出CCl3COOH.你认为此方案是否可行,为什么?不可行,CCl3COOH溶于乙醇与CCl3CHO.
(4)装置E中可能发生的无机反应的离子方程式有Cl2+2OH-=Cl-+ClO-+H2O、H++OH-=H2O.
(5)测定产品纯度:称取产品0.30g配成待测溶液,加入0.1000mol•L-1碘标准溶液20.00mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000mo1•L-1Na2S2O3溶液滴定至终点.进行平行实验后,测得消耗Na2S2O3溶液20.00mL.则产品的纯度为88.5%.(CCl3CHO的相对分子质量为147.5)
滴定的反应原理,:CCl3CHO+OH-═CHCl3+HCOO-
HCOO-+I2═H++2I-+CO2↑ I2+2S2O32-═2I-+S4O62-
(6)已知:常温下Ka(CCl3COOH)=1.0×10-1mol•L-1,Ka (CH3COOH)=1.7×10-5mol•L-1
请设计实验证明三氯乙酸、乙酸的酸性强弱.
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
 .
.