题目内容
下列事实不能用勒夏特列原理解释的是( )
| A、溴水中有下列平衡Br2+H2O?HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅 |
| B、合成氨反应,为提高氨的产率,理论上应采取降低温度的措施 |
| C、反应CO(g)+NO2(g)?CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 |
| D、对于2NO2(g)?N2O4(g),达平衡后,缩小容器体积可使体系颜色变深 |
考点:化学平衡移动原理
专题:
分析:勒夏特列原理为:如果改变影响平衡的条件之一,平衡将向着能够减弱这种改变的方向移动.使用勒夏特列原理时,该反应必须是可逆反应,且存在平衡移动,否则勒夏特列原理不适用.
解答:
解:A.加入硝酸银溶液后,生成AgBr沉淀,溴离子浓度减小,平衡向正方向移动,促进溴与水的反应,溶液颜色变浅,可用勒夏特列原理解释,故A不选;
B.合成氨反应为放热反应,较低温度有利于平衡向正反应方向移动,可用勒夏特列原理解释,故B不选;
C.正反应为放热反应,升高温度平衡向逆反应方向移动,体系颜色变深,可用勒夏特列原理解释,故C不选;
D.对于2NO2(g)?N2O4(g),缩小容器体积平衡正向移动,但体系颜色变深,不能用勒夏特列原理解释,故D选;
故选D.
B.合成氨反应为放热反应,较低温度有利于平衡向正反应方向移动,可用勒夏特列原理解释,故B不选;
C.正反应为放热反应,升高温度平衡向逆反应方向移动,体系颜色变深,可用勒夏特列原理解释,故C不选;
D.对于2NO2(g)?N2O4(g),缩小容器体积平衡正向移动,但体系颜色变深,不能用勒夏特列原理解释,故D选;
故选D.
点评:本题考查了勒夏特列原理的使用条件,难度不大,注意使用勒夏特列原理的前提必须是可逆反应且存在平衡移动,易错点为B,注意从提高产率的角度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
一定条件下,可逆反应N2+3H2?2NH3(正反应为放热反应)达到平衡,当单独改变下述条件后,有关叙述错误的是( )
| A、加催化剂,V正、V逆 都发生变化,且变化的倍数相等 |
| B、加压,V正、V逆 都增大,且V正 增大的倍数大于V逆增大的倍数 |
| C、降温,V正、V逆 都减小,且V正 减小的倍数大于V逆减小的倍数 |
| D、增大氮气的浓度,V正、V逆 都增大,且V正 增大倍数大于V逆 增大倍数;N2 转换率减小,H2转化率增大 |
化学与人类生活、社会可持续发展密切相关.下列说法正确的是( )
| A、制作快餐饭盒的可降解“玉米塑料”(主要成分是聚乳酸)是纯净物 |
| B、“天宫一号”使用的碳纤维,是一种新型有机高分子材料 |
| C、福尔马林可作食品的保鲜剂 |
| D、用CO2合成聚碳酸酯可降解塑料,实现碳的循环利用 |
下列说法正确的是( )
A、c(H+)=
| ||
| B、将水加热,KW增大,pH不变,仍呈中性 | ||
| C、向水中加入少量碳酸氢钠固体,溶液的c(H+) 增大,KW不变 | ||
| D、向0.1 mol?L-1醋酸溶液中加水,溶液中水电离产生的c(H+) 将减小 |
在一定条件下,RO-与R-可发生反应:RO3-+5R-+6H+═3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A、元素R位于周期表中第ⅤA族 |
| B、RO3-中的R只能被还原 |
| C、R2在常温常压下一定是气体 |
| D、若1 mol RO3-参与该反应,则转移的电子的物质的量为5 mol |
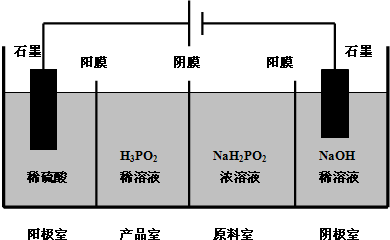 次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
次磷酸(H3PO2)是一种精细磷化工产品,具有较强的还原性.回答下列问题:
