题目内容
18.除去下列物质中的杂质(括号内为杂质),所选用的试剂不正确的一组是( )| 选项 | 待提纯的物质 | 选用试剂 |
| A | FeCl3溶液(FeCl2溶液) | Cl2 |
| B | NaCl溶液(Na2SO4溶液) | Ba(NO3)2溶液 |
| C | Cl2(HCl) | 饱和食盐水 |
| D | CO2(SO2) | 酸性KMnO4溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.亚铁离子具有还原性,亚铁离子与氯气反应生成铁离子;
B.加入硝酸钡引入新的杂质;
C.食盐水抑制氯气的溶解;
D.二氧化硫有还原性.
解答 解:A.亚铁离子具有还原性,且亚铁离子与氯气反应生成铁离子,可除杂,故A正确;
B.加入硝酸钡引入新的杂质,不符合除杂原则,故B错误;
C.HCl极易溶于水,食盐水抑制氯气的溶解,除杂合理,故C正确;
D.二氧化硫有还原性,能被酸性高锰酸及氧化生成硫酸,故D正确.
故选B.
点评 本题考查混合物分离提纯及检验,为高频考点,把握物质的性质及性质差异等为解答的关键,注意鉴别有明显现象、除杂不能引入新杂质等,题目难度不大.

练习册系列答案
相关题目
9.下列关于硝酸的认识中,正确的是( )
| A. | 浓硝酸和稀硝酸都具有氧化性 | |
| B. | 浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气 | |
| C. | 因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中 | |
| D. | 硝酸与金属反应时,只表现出氧化性 |
6.常温常压下为无色液体,而且密度大于水的是( )
| A. | 乙醇 | B. | 一氯甲烷 | C. | 溴苯 | D. | 乙酸乙酯 |
3. 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
 用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )
用如图所示装置进行下列实验,实验结果与预测的现象不一致的是( )| 选项 | ①中的物质 | ②中的物质 | 预测装置中现象 |
| A | NO2 | 蒸馏水 | 试管充满无色溶液 |
| B | SO2 | 紫色石蕊溶液 | 溶液逐渐变为红色 |
| C | NH3 | AlCl3溶液 | 产生白色沉淀 |
| D | Cl2 | AgNO3溶液 | 产生白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
7.下列操作不能达到目的是( )
| 选项 | 目的 | 操作 |
| A | 配制100mL1.0mol•L-1 CuSO4溶液 | 将25g CuSO4•5H2O溶于100mL蒸馏水中 |
| B | 除去固体Na2CO3中的少量NaHCO3 | 将混合物加热充分反应 |
| C | 在溶液中将MnO4-完全转化为Mn2+ | 向酸性KMnO4溶液中通入SO2气体至紫色消失 |
| 确定NaCl溶液中是否混有Na2CO3 | 取少量溶液滴加CaCl2溶液,观察是否出现白色浑浊 |
| A. | A | B. | B | C. | C | D. | D |
8.下列物质中不能发生水解反应的是( )
| A. | 葡萄糖 | B. | 油脂 | C. | 蛋白质 | D. | 纤维素 |
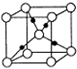 已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.
已知A、B、C、D、E、F、G、H均为前四周期元素且原子序数依次增大,A的原子中没有成对电子;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;元素C的基态原子2p轨道有3个未成对电子,元素D的原子最外层电子数是其内层电子数的3倍,元素F的一种常见单质为淡黄色粉末,G的内层轨道全部排满电子,且最外层电子数为1.E是地壳中含量最高的金属元素;H与E同主族.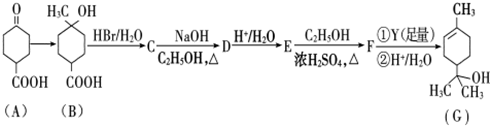
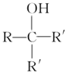
 .
.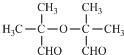 .
. X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.
X、Y、Z是同周期的短周期元素,原子序数依次增大.Y为地壳中含量最高金属元素,且X、Y、Z的最高价氧化物对应水化物两两之间可以相互反应.