题目内容
7.化学与生产、生活、社会发展等息息相关,下列说法正确的是( )| A. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| B. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 | |
| C. | 为补充土壤中的钾元素,可在田间焚烧桔秆 | |
| D. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 |
分析 A.煤经过气化生成CO和氢气、液化生成甲醇;
B.Fe具有还原性;
C.田间焚烧桔秆,可排放有害物质及固体颗粒;
D.聚氯乙烯使用时排放含氯的有毒物质.
解答 解:A.煤经过气化生成CO和氢气、液化生成甲醇,减少污染物的排放,为化学变化转变为清洁燃料,故A错误;
B.Fe具有还原性,则在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质,故B正确;
C.田间焚烧桔秆,可排放有害物质及固体颗粒,则不能在田间焚烧桔秆,故C错误;
D.聚氯乙烯使用时排放含氯的有毒物质,还有塑化剂等,会造成环境污染,一般选聚乙烯作包装材料,故D错误;
故选B.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、化学与环境、材料的关系为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案
相关题目
5.X、Y、Z、W为原子序数依次增大的四种第三周期元素,其单质及其化合物的性质或结构信息如表所示,用化学用语回答下列问题.
请按要求回答下列问题:
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为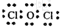 ;
;
(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
| 元素 | X | Y | Z | W |
| 性质 结构 信息 | 工业上常用电解熔融XW2制取X的单质. | Y的最外层电子数比最内层电子数多1. | Z的最高价氧化物的水化物经聚合、脱水,可作袋装食品干燥剂. | W的一种气态氧化物甲对空气的相对密度为3,它溶于水得到单一溶质的弱酸性溶液(有漂白性),该溶液光照后酸性增强. |
(1)工业上制取X的单质的化学方程式:MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑.
(2)X、Y、W三种元素对应的离子半径由大到小的顺序为:Cl->Mg2+>Al3+.
(3)在25℃、101kPa下,已知13.5g的Y的固体单质在W的气体单质中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式是2Al(s)+3Cl2(g)=2AlCl3(s)△H=-1676kJ/mol.
(4)甲中各原子都满足8电子稳定结构,其电子式为
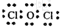 ;
;(5)Sn与元素Z同主族,周期数比元素Z的大2.则Sn的原子序数为50;已知锡在水溶液中有Sn2+、Sn4+两种存在形式,且硫酸盐均可溶.酸性条件下,SnSO4可用作双氧水的去除剂,试写出所发生反应的离子方程式:Sn2++H2O2+2H+═Sn4++2H2O.潮湿环境中,镀锡铜如果锡层破损不能(填“能”或“不能”)形成铜绿.
18.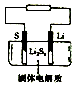 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
 石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )
石墨烯锂硫电池是一种高效、低污染的新型二次电源,其装置如图所示.电池反应为 2Li+nS=Li2Sn.Li+可在固体电解质中迁移.下列说法不正确的是( )| A. | 放电时,锂在负极上发生氧化反应 | |
| B. | 放电时,正极的电极反应式为nS+2e-+2Li+=Li2Sn | |
| C. | 充电时,锂电极为阴极,与电源负极相连 | |
| D. | 充电时,理论上阳极失去2mol电子生成32g硫 |
15.短周期元素X、Y、Z、W在元素周期表中的相对位置如表所示,Z在周期表中处于周期序数等于族序数的位置.下列说法错误的是( )
| X | Y | |||
| Z | W |
| A. | 原子半径:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Z与Y的简单离子的电子层结构相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的弱 | |
| D. | X的简单氢化物与Y的氢化物化合产物中含有离子键和共价键 |
2.硼泥主要由MgO和SiO2组成,含有少量Fe2O3、FeO、Al2O3等杂质.用硼泥生产氢氧化镁的工艺流程如图所示,已知生成氢氧化物沉淀的pH见表.下列说法正确的是( )


| 氢氧化物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Mg(OH)2 | 9.3 | 10.8 |
| Fe(OH)2 | 7.6 | 9.6 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| A. | 反应①中H2O2主要用于还原剂 | |
| B. | 滤渣1和滤渣2都不能溶于NaOH溶液 | |
| C. | 反应③发生主要反应的离子方程式:H++OH-═H2O | |
| D. | 以滤渣2为原料可以制备涂料铁红 |
12.为实现相关实验目的,选用的试剂、装置和操作均合理的是( )
| 实验目的 | 实验内容 | |
| A | 证明氨水中存在一水合氨的电离平衡 | 向含有酚酞的氨水中加入少量NaOH固体 |
| B | 配制100mL1.0mol•L-1 NaOH 溶液 | 向100mL容量瓶中加入4.0g NaOH固体,加水到刻度线 |
| C | 模拟利用牺牲阳极的阴极保护法保护铁 | 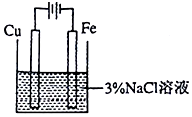 |
| D | 比较Cl-和I-的还原性 | 将少量Cl2通入滴有淀粉溶液的KI溶液中 |
| A. | A | B. | B | C. | C | D. | D |
19.某溶液中只可能含有K+、Al3+、Br-、OH-、CO32-、SO32-中的一种或几种.取样,滴加足量氯水,有气泡产生,溶液变为橙色;向橙色溶液中加BaCl2溶液无明显现象.为确定该溶液的组成,还需检验的离子是( )
| A. | Br- | B. | OH- | C. | K+ | D. | Al3+ |
16.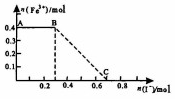 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )| A. | 参加反应的铁粉为0.4mol | |
| B. | 氧化性:HNO3>I2 | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | 稀硝酸的浓度为0.5mol/L |
18.将0.1mol天然碱(2Na2CO3•NaHCO3•2H2O)溶于水配成1L溶液,下列关于该溶液的说法正确的是( )
| A. | c(CO32-)+c(HCO3-)=0.3mol•L-1 | B. | c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H-) | ||
| C. | c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | D. | c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |