题目内容
16.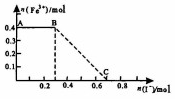 将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )
将一定量的铁粉投入1000mL稀硝酸充分反应后,再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示.下列说法中不正确的是( )| A. | 参加反应的铁粉为0.4mol | |
| B. | 氧化性:HNO3>I2 | |
| C. | 图中BC段发生的反应为2Fe3++2I-═2Fe2++I2 | |
| D. | 稀硝酸的浓度为0.5mol/L |
分析 由图可知,Fe与稀硝酸发生Fe+4H++NO3-=Fe3++NO↑+2H2O,且硝酸剩余,加0.3molKI发生6I-+8H++2NO3-=3I2+2NO↑+4H2O,BC段发生2Fe3++2I-═2Fe2++I2,以此来解答.
解答 解:A.由图可知生成n(Fe3+)=0.4mol,由Fe原子守恒可知,参加反应的铁粉为0.4mol,故A正确;
B.由图可知,加0.3molKI发生6I-+8H++2NO3-=3I2+2NO↑+4H2O,则氧化性:HNO3>I2,故B正确;
C.BC段铁离子减少,则BC段发生的反应为2Fe3++2I-═2Fe2++I2,故C正确;
D.Fe+4H++NO3-=Fe3++NO↑+2H2O中0.4molFe消耗硝酸为1.6mol,6I-+8H++2NO3-=3I2+2NO↑+4H2O中消耗硝酸为0.3mol×$\frac{8}{6}$=0.4mol,则稀硝酸的浓度为$\frac{1.6mol+0.4mol}{1L}$=2mol/L,故D错误;
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的氧化还原反应、铁离子物质的量的变化为解答的关键,侧重分析与计算能力的考查,注意Fe与硝酸反应时硝酸剩余,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.下列有关说法正确的是( )
| A. | 常温下,向含Ag2S固体的溶液中滴加少量Na2S溶液,c(Ag+)、c(S2-)、Ksp(Ag2S)都减小 | |
| B. | 常温下,pH=10的K2CO3溶液和pH=4的FeCl3溶液中,水的电离程度后者小 | |
| C. | 含KHSO3和K2SO3的中性混合溶液中有c(K+)=c(HSO3-)+2c(SO32-) | |
| D. | 常温下,将pH=2的HX溶液稀释1000倍,稀释后溶液的pH一定为5 |
7.化学与生产、生活、社会发展等息息相关,下列说法正确的是( )
| A. | 煤经过气化、液化等物理变化可转变为清洁燃料 | |
| B. | 在食品包装时放入盛有铁粉的透气小袋可防止食品氧化变质 | |
| C. | 为补充土壤中的钾元素,可在田间焚烧桔秆 | |
| D. | 聚乙烯、聚氯乙烯均可作包装材料,且不会造成环境污染 |
4.向制作印刷电路板的废液中,分别加入指定物质,反应后的溶液中主要存在的一组离子正确的是( )
| A. | 加入过量氨水:NH4+、Cl-、[Cu(NH3)4]2+ | |
| B. | 通入过量Cl2:Fe2+、Cu2+、C-、H+ | |
| C. | 加入过量铁粉:Cu2+、Fe2+、Cl-、H+ | |
| D. | 加入过量KSCN溶液:Na+、K+、Fe3+、H+ |
11.酚醛树脂M结构如图,下列说法不正确的是( )


| A. | M是合成高分子化合物 | B. | n是一个定值 | ||
| C. | 可用苯酚和甲醛合成M | D. | 合成M的反应缩聚反应 |
9. X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
 X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )
X、Y、Z 三种短周期元素,原子半径的大小关系为:r(Y)>r(X)>r(Z),原子序 数之和为 16.X、Y、Z 三种元素的常见单质在适当条件下可发生如图所示变化,其中 B 和 C 均为 10 电子分子.下列说法不正确的是( )| A. | X 元素位于ⅥA | B. | A 不能溶解于 B 中 | ||
| C. | B 的沸点高于 C 的沸点 | D. | A 和 C 不可能发生氧化还原反应 |
6.下列实验所用试剂、现象和结论均正确的是( )
| 序号 | 相关实验 | 试剂 | 现象和结论 |
| ① | 鉴别K2CO3和Na2SO4 | 盐酸、澄清的石灰水 | 产生无色无味气体,能使澄清的石灰水变浑浊的是K2CO3 |
| ② | 鉴别NO2和Br2蒸气 | 湿润的淀粉KI试纸 | 试纸变蓝色的是Br2蒸气 |
| ③ | 鉴别葡萄糖和蔗糖 | 银氨溶液 | 有银镜产生的葡萄糖 |
| ④ | 将装满氯水的圆底烧瓶倒置在有氯水的水槽中,日光照射 | -- | 烧瓶内有气泡产生,说明日光照射导致溶解的Cl2逸出 |
| A. | ①③ | B. | ①② | C. | ②④ | D. | ②③ |
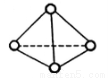 ),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN
),与白磷分子相似。已知断裂1molN—N键吸收193kJ热量,断裂1molN N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。
N键吸收941kJ热量,则1molN4气体转化为2molN2时要放出______________kJ能量。