题目内容
1.根据表中信息判断,下列选项正确的是( )| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |
分析 依据氧化还原反应中原子守恒,电子守恒和电荷守恒分析配平化学方程式判断选项;
A、锰元素化合价降低,过氧化氢中氧元素化合价升高生成氧气;
B、亚铁离子还原性大于溴离子,产物说明氯气反应过程中亚铁离子全部氧化,溴离子部分氧化;
C、依据反应2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,计算电子转移;
D、氧化还原反应中氧化剂的氧化性大于氧化产物分析判断.
解答 解:A、锰元素化合价降低,过氧化氢中氧元素化合价升高生成氧气,2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+8H2O+5O2↑,故A错误;
B、3C12+6FeBr2=2FeC13+4FeBr3 ,亚铁离子还原性大于溴离子,产物说明氯气反应过程中亚铁离子全部氧化,溴离子部分氧化,Cl2与FeBr2的物质的量之比小于或等于1:2,故B正确;
C、2MnO4-+16H++10Cl-=5Cl2↑+2Mn2++8H2O,生成5mol Cl2,转移电子10mol,故C错误;
D、氧化剂的氧化性大于氧化产物,依据化学方程式分析判断,氧化性由强到弱顺序为MnO4->Cl2>Br2>Fe3+,故D错误;
故选B.
点评 本题考查了氧化还原反应反应实质、电子转移的计算应用,主要是反应产物的判断,掌握离子性质和氧化还原反应规律应用是解题关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O下列有关说法中不正确的是( )
| A. | HNO3在反应中既表现氧化性也表现出酸性 | |
| B. | 每生成22.4 L NO(标准状况)有3 mol电子转移 | |
| C. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3 | |
| D. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3 |
6.河虾不宜与西红柿同食,主要原因是河虾中含+5价砷,西红柿中含有较多的维生素C,两者同食会产生有毒的+3价砷.据此,下列说法不正确的是( )
| A. | 该反应中维生素C作还原剂 | |
| B. | 河虾与其它含维生素C较多蔬菜也不宜同食 | |
| C. | 河虾与西红柿同食发生了氧化还原反应 | |
| D. | 该反应中砷元素被氧化 |
10.硅及其化合物的开发由来已久,在现代生活中有广泛应用.回答下列问题.
(1)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:
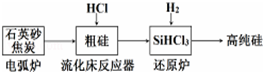
①还原炉中发生主要反应的化学方程式为SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si+3HCl,该工艺中可循环使用的物质为HCl和H2(填化学式).用石英砂和焦炭在电弧炉中高温加热也可以生产碳化硅,该反应的化学方程式为SiO2+3C$\frac{\underline{\;高温\;}}{\;}$SiC+2CO↑.
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
③SiHCl3极易水解,其完全水解的化学方程式为SiHCl3+3H2O═H2SiO3+H2↑+3HCl↑.
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4遇空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2.
①由SiCl4和NH3反应制取Si3N4的化学方程式为3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
③Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成SiO2物质(填化学式).热处理后除去MgO和Mg3N2的方法是加足量稀盐酸过滤.
(1)工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如图:

| 发生的主要反应 | |
| 电弧炉 | SiO2+2C$\frac{\underline{\;1600-1800℃\;}}{\;}$si+2CO |
| 流化床反应器 | Si+3HCl$\frac{\underline{\;250-300\;}}{\;}$SiHCl3+H2 |
| 还原炉 |
②在流化床反应的产物中,SiHCl3大约占85%,还有SiCl4、SiH2Cl2、SiH3Cl等,有关物质的沸点数据如表,提纯SiHCl3的主要工艺操作依次是沉降、冷凝和精馏.
| 物质 | Si | SiCl4 | SiHCl3 | SiH2Cl2 | SiH3Cl | HCl | SiH4 |
| 沸点/°C | 2355 | 57.6 | 31.8 | 8.2 | -30.4 | -84.9 | -111.9 |
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状态的Si3N4可以由SiCl4的蒸气和NH3反应制取.粉末状Si3N4遇空气和水都不稳定,但将粉末状的Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理,可以制得结构十分紧密、对空气和水都相当稳定的固体材料,同时还得到遇水不稳定的Mg3N2.
①由SiCl4和NH3反应制取Si3N4的化学方程式为3SiCl4+4NH3$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
②四氯化硅和氮气在氢气气氛保护下,加强热发生反应,使生成的Si3N4沉积在石墨表面可得较高纯度的氮化硅,该反应的化学方程式为3SiCl4+2N2+6H2$\frac{\underline{\;高温\;}}{\;}$Si3N4+12HCl.
③Si3N4和适量氧化镁在230×1.01×105Pa和185℃的密闭容器中进行热处理的过程中,除生成Mg3N2外,还可能生成SiO2物质(填化学式).热处理后除去MgO和Mg3N2的方法是加足量稀盐酸过滤.
11.下列物质中,可用作净水剂的是( )
| A. | 纯碱 | B. | 明矾 | C. | 蔗糖 | D. | 火碱 |
 .
.
 A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元索,A2-和B+具有相同的电子构型;C、D为同周期元索,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题: