题目内容
12.新型无机非金属材料甲和乙均是高温陶瓷材料,硬度大、熔点高、化学性质稳定.甲、乙分别由原子序数依次增大的X、Y、Z三种短周期元素中的两种组成.甲与NaOH浓溶液共热生成气体丙和化合物丁,丙在标准状况下的密度为0.76g•L-1,在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解.Z元素的氧化物是制造光导纤维的主要材料,在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙.请回答下列问题:(1)乙的化学式为Si3N4;丙的电子式为
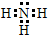 .
.(2)甲与NaOH浓溶液共热的化学方程式为AlN+NaOH+H2O=NaAlO2+NH3↑.
(3)高温条件下,丙与Fe2O3反应生成Fe和X单质,写出该反应的化学方程式为2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O+N2,有人提出生成的产物Fe中可能还有FeO,请设计实验方案验证之(用化学方法)取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成.
(4)工业上在X单质的气氛下将Z的氧化物和焦炭加热到1400℃~1450℃的条件下以制备乙,反应中还生成一种常见的可燃性气体戊,该反应的化学方程式为3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
分析 丙在标准状况下的密度为0.76g•L-1,丙的摩尔质量为0.76g•L-1×22.4L/mol≈17g/mol,则丙为NH3,则甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,所以甲为AlN,丁为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为Si3N4,据此解答.
解答 解:丙在标准状况下的密度为0.76g•L-1,丙的摩尔质量为0.76g•L-1×22.4L/mol≈17g/mol,则丙为NH3,则甲中含有N元素;在丁溶液中滴加盐酸至过量,先生成白色沉淀后溶解,说明丁中含有铝元素,则甲中含有Al元素,所以甲为AlN,丁为NaAlO2;Z元素的氧化物是制造光导纤维的主要材料,所以Z为Si元素,而X、Y、Z三种短周期元素且原子序数依次增大,所以X为N、Y为Al;在1300℃~1400℃的条件下,0.1mol的X单质与4.2g的Z单质恰好反应制得乙,即0.1mol氮气与0.15molSi反应,生成的乙中氮原子与硅原子个数之比为:0.2:0.15=4:3,所以乙的化学式为Si3N4.
(1)由上述分析可知,乙的化学式为Si3N4;丙为NH3,电子式为: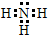 ,
,
故答案为:Si3N4;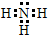 ;
;
(2)甲为AlN,AlN与NaOH浓溶液共热生成了氨气和偏铝酸钠,反应的化学方程式为:AlN+NaOH+H2O=NaAlO2+NH3↑,
故答案为:AlN+NaOH+H2O=NaAlO2+NH3↑;
(3)丙为氨气,X的单质为氮气,高温条件下,氨气与Fe2O3反应生成Fe和氮气单质,反应的化学方程式为:2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O+N2;
产物Fe中可能还有FeO,需要先除掉铁,然后用盐酸溶解,再检验是否含有亚铁离子,检验方法为:取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成,
故答案为:2NH3+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3H2O+N2;取样品少许,溶于足量的CuSO4溶液,充分反应后,过滤所得的滤渣溶于稀盐酸,滴加硫氰化钾溶液,没有明显现象,再滴加氯水,若溶液呈红色,则证明有FeO生成;
(4)X的单质为N2,Z的氧化物为SiO2,工业上在N2的气氛下将SiO2和焦炭加热到1400℃~1450℃的条件下以制备Si3N4,反应中还生成一种常见的可燃性气体戊,根据原子守恒,可燃性气体中含有C,所以为CO,该反应的化学方程式为:3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO,
故答案为:3SiO2+2N2+6C$\frac{\underline{\;高温\;}}{\;}$Si3N4+6CO.
点评 本题考查了无机物的推断,题目难度较大,注意从气体丙的密度及丁中加入盐酸反应信息进行推断,试题培养了学生的分析理解能力及灵活应用所学知识的能力.

| A. | 氮气 | B. | 铁 | C. | 甲烷气体 | D. | 二氧化硫气体 |
| A. | 丙酸与甲酸乙酯 | B. | 乙醛与乙酸 | C. | 葡萄糖与麦芽糖 | D. | 蔗糖与麦芽糖 |
| A. | 石英坩埚耐高温,可用来加热熔融氢氧化钠固体 | |
| B. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均变质 | |
| D. | 甲醛可用作食品防腐剂 |
①Na2O2和CO2 ②NaOH和CO2 ③Na和O2 ④Na2CO3和HCl ⑤AlCl3和NaOH ⑥NaAlO2和CO2 ⑦Fe和HCl ⑧Ca(OH)2和NaHCO3.
| A. | ①⑥⑦⑧ | B. | ①⑥ | C. | ①⑦ | D. | ①④⑦ |
形.故近朱者赤,近墨者黑.”这里的“朱”指的是( )
| A. | Fe3 04 | B. | CuO | C. | HgS | D. | FeS |
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |