题目内容
11.3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O下列有关说法中不正确的是( )| A. | HNO3在反应中既表现氧化性也表现出酸性 | |
| B. | 每生成22.4 L NO(标准状况)有3 mol电子转移 | |
| C. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原8 mol的HNO3 | |
| D. | HNO3作氧化剂,铜作还原剂,3 mol Cu还原2 mol的HNO3 |
分析 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O中,Cu元素的化合价升高,N元素的化合价降低,所以硝酸反应表现出氧化性,生成硝酸盐时表现出酸性,然后利用化合价的变化来分析转移的电子数.
解答 解:A、因反应中Cu元素的化合价升高,N元素的化合价降低,则Cu作还原剂,HNO3作氧化剂,表现出氧化性,因部分硝酸反应生成硝酸盐时表现出酸性,故A正确;
B、由反应可知,生成2molNO转移的电子为6mol,22.4L(标准状况)NO的物质的量为$\frac{22.4L}{22.4L/mol}$=1mol,则转移的电子为3mol,故B正确;
C、由上述分析可知:NO中的N为+2价,HNO3中的N为+5价.所以生成的2molNO都是由HNO3被还原得到的,所以有2mol的HNO3作氧化剂HNO3作氧化剂,铜作还原剂,总共有3mol的Cu被氧化所以Cu做还原剂,所以氧化剂和还原剂之比就为2:3,故C错误;
D、由C分析可知,3 mol Cu还原2 mol的HNO3,故正确;
故选:C.
点评 本题考查了氧化还原反应,明确硝酸中氮元素的化合价变化是解答本题的关键和难点,化合价升高的是氧化剂,化合价降低的是还原剂,要细心分析解答.

练习册系列答案
相关题目
2.下列各种物质中,由原子直接构成的是( )
| A. | 氮气 | B. | 铁 | C. | 甲烷气体 | D. | 二氧化硫气体 |
19.某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)?cC(g)表示]的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率).根据图象,下列判断正确的是( )
| A. |  如图反应:若p1>p2,则此反应只能在高温下自发进行 | |
| B. | 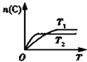 如图反应:此反应的△H<0,且T1<T2 | |
| C. | 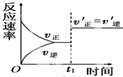 如图反应:表示t1时刻一定是使用催化剂对反应速率的影响 | |
| D. | 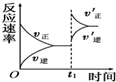 如图反应:表示t1时刻增大B的浓度对反应速率的影响 |
3.下列物质可用新制Cu(OH)2悬浊液来鉴别,但不是同分异构体的是( )
| A. | 丙酸与甲酸乙酯 | B. | 乙醛与乙酸 | C. | 葡萄糖与麦芽糖 | D. | 蔗糖与麦芽糖 |
20.下列有关物质的性质及应用说法正确的是( )
| A. | 石英坩埚耐高温,可用来加热熔融氢氧化钠固体 | |
| B. | 聚氯乙烯塑料在日常生活中可用来进行食品包装 | |
| C. | 硫酸亚铁溶液和水玻璃在空气中久置后均变质 | |
| D. | 甲醛可用作食品防腐剂 |
1.根据表中信息判断,下列选项正确的是( )
| 序号 | 反应物 | 产物 |
| 1 | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
| 2 | Cl2、FeBr2 | FeCl3、FeBr3 |
| 3 | MnO4-、Cl-… | Cl2、Mn2+… |
| A. | 第①组反应的其余产物为H20 | |
| B. | 第②组反应中CI2与FeBr2的物质的量之比小于或等于1:2 | |
| C. | 第③组反应中生成1mol Cl2,转移电子5 mol | |
| D. | 氧化性由强到弱顺序为Mn04->Cl2>Fe3+>Br2 |
