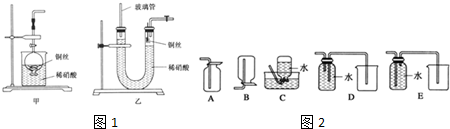
题目内容
20.甲、乙、丙均为化合物,其中甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体.它们有如下图的转化关系,已知D为黄绿色气体,按要求回答下列问题: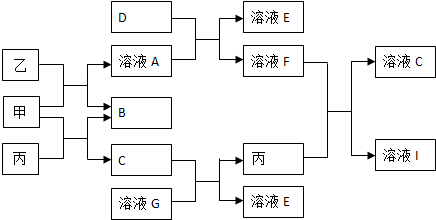
(1)甲物质为Na2O2(填化学式).
(2)1mol乙和足量甲反应可生成0.5mol B物质;1mol丙和足量甲反应可生成0.5mol B物质.
(3)D能使湿润的有色布条褪色,其褪色原因是溶于水生成HClO,HClO有强氧化性,能将有色物质氧化为无色物质,而使布条褪色.
(4)丙与溶液F反应的化学方程式为CO2+NaClO+H2O=NaHCO3+HClO.
分析 甲、乙、丙均为化合物,甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,甲能既能与乙反应也能与丙反应,可知甲为Na2O2,乙为H2O,丙为CO2,则A为NaOH,B为O2,C为Na2CO3.D为黄绿色气体,则D为Cl2,D(氯气)与A(氢氧化钠)反应生成NaCl、NaClO,F能与丙(二氧化碳)反应C与I,则F为HClO、E为NaCl、I为NaHCO3.G与C(碳酸钠)反应得到E(氯化钠)与丙(二氧化碳),则G为HCl,据此解答.
解答 解:甲、乙、丙均为化合物,甲为淡黄色的固体,乙常温下为无色无味液体,丙为常见的无色无味气体,甲能既能与乙反应也能与丙反应,可知甲为Na2O2,乙为H2O,丙为CO2,则A为NaOH,B为O2,C为Na2CO3.D为黄绿色气体,则D为Cl2,D(氯气)与A(氢氧化钠)反应生成NaCl、NaClO,F能与丙(二氧化碳)反应C与I,则F为HClO、E为NaCl、I为NaHCO3.G与C(碳酸钠)反应得到E(氯化钠)与丙(二氧化碳),则G为HCl.
(1)由上述判断可知,甲物质为Na2O2,
故答案为:Na2O2;
(2)乙与足量的甲发生反应:2Na2O2+2H2O=4NaOH+O2↑,1mol水反应可以生成0.5mol氧气,丙和足量甲发生反应:2Na2O2+2CO2=O2+2Na2CO3,1mol二氧化碳反应生成0.5mol氧气,
故答案为:0.5;0.5;
(3)D(氯气)能使湿润的有色布条褪色,其褪色原因是:溶于水生成HClO,HClO有强氧化性,能将有色物质氧化为无色物质,而使布条褪色,
故答案为:溶于水生成HClO,HClO有强氧化性,能将有色物质氧化为无色物质,而使布条褪色;
(4)丙与溶液F反应是二氧化碳与次氯酸钠反应生成碳酸氢钠与HClO,反应的化学方程式为:CO2+NaClO+H2O=NaHCO3+HClO,
故答案为:CO2+NaClO+H2O=NaHCO3+HClO.
点评 本题考查无机物推断,“甲为淡黄色的固体且能与无色液体反应、与无色无味气体反应”是推断突破口,熟练掌握元素化合物性质,注意二氧化碳与次氯酸盐溶液反应,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
| A. | H×+ → → | B. | Na×+ → → | ||
| C. |  | D. |  |
| A. | “地沟油”禁止食用,但可以用来制肥皂 | |
| B. | 氢氧化铝、碳酸氢钠都可用于治疗胃酸过多 | |
| C. | 为改善食物的色、香、味并防止变质,可在其中加入适量食品添加剂 | |
| D. | 用化纤面料替代棉质面料,以减少二氧化碳的排放 |
| A. | 青砖(含Fe3O4)中的Fe2+可用浓盐酸溶解后,再加入适量高锰酸钾溶液进行检验 | |
| B. | 用0.1000 mol•L-1 NaOH溶液滴定20.00 mL未知浓度盐酸,接近终点时因滴速太快造成NaOH少许过量;此时若加入一定体积该盐酸后,继续用该NaOH溶液恰好滴定至终点,则测得的盐酸浓度将偏大 | |
| C. | 为了使实验现象明显,在做吸氧腐蚀实验时,不能用没有处理过的镀锌铁皮代替生铁 | |
| D. | 检查容量瓶瓶口是否漏水的方法是:往瓶内加入一定量水,塞好瓶塞.用食指摁住瓶塞,另一只手托住瓶底,把瓶倒转过来,观察瓶塞周围是否有水漏出即可 |


 )的说法正确的是AD.
)的说法正确的是AD.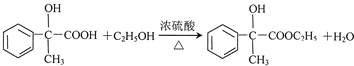 .
.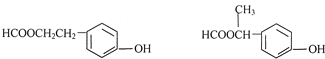 .
.