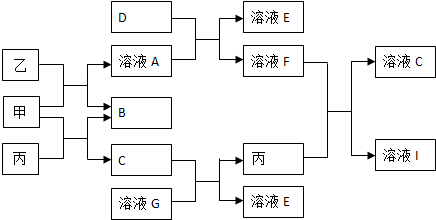
题目内容
9.下列关于元素的叙述正确的是( )| A. | 分子式符合XY2型的化合物可能由同一主族元素构成 | |
| B. | 只有在原子中,质子数才与核外电子数相等 | |
| C. | 目前使用的元素周期表中,最长的周期含有36种元素 | |
| D. | 所有的非金属元素都位于元素周期表的右半区 |
分析 A.分子式符合XY2型可能是SO2、CO2;
B.分子中质子数等于电子数;
C.根据元素周期表判断;
D.第IA主族中的H元素属于非金属元素.
解答 解:A.分子式符合XY2型可能是SO2、CO2,其中SO2的S、O元素属于同一主族,故A正确;
B.不仅原子中质子数与核外电子数相等,而且分子中质子数也等于电子数,故B错误;
C.在周期表中,第六周期和第七周期分别含有32种元素,含有的元素种类最多,所以目前使用的元素周期表中最长的周期含有32种元素,故C错误;
D.第IA主族中的H元素属于非金属元素,H元素位于元素周期表的左半区,故D错误.
故选A.
点评 本题考查了元素周期表的结构和应用,题目难度不大,侧重于基础知识的考查,注意把握常见元素在周期表中的位置.

练习册系列答案
相关题目
19.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
涉及到填写的物质写元素符号或化学式
(1)写出②号形成的单质的电子式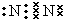 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是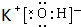 .
.
(3)单质硬度最大的元素是C其氢化物结构式为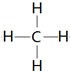 .
.
(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物: ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1)写出②号形成的单质的电子式
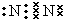 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是
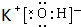 .
.(3)单质硬度最大的元素是C其氢化物结构式为
 .
.(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物:
 ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
4.下列有关电解质溶液中粒子的物质的量浓度大小关系正确的是( )
| A. | 等物质的量浓度的下列溶液:①H2CO3、②Na2CO3、③NaHCO3、④(NH4)2CO3:其中c(CO32-)的大小关系为:②>④>③>① | |
| B. | pH=2 的H2C2O4溶液与pH=12的NaOH溶液等体积混合:c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+c(C2O42-) | |
| C. | 向0.2 mol•L-1NaHCO3 溶液中加入等体积0.1 mol•L-1NaOH 溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 常温下,同浓度的CH3COONa与CH3COOH 溶液等体积混合,溶液的pH<7:c(CH3COOH)+c(OH-)>c(Na+)+c(H+) |
14.下列说法正确的是( )
| A. | 1.5g-CH3中含有的电子数为6.02×1023 | |
| B. | 标准状况下.22.4L NO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 | |
| C. | 工业上用电解法精炼粗铜时,每转移1mo1电子,阳极上溶解的铜原子数必为0.5×6.02×1023 | |
| D. | VL amo1•L-1氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023. |
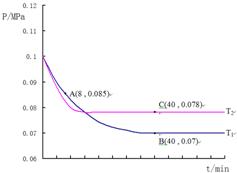
1.草酸是二元中强酸,草酸氢钠溶液显酸性.常温下,向10mL 0.01mol/L NaHC2O4溶液中滴加0.01mol/L NaOH溶液,随着NaOH溶液体积的增加,溶液中离子浓度关系正确的是( )
| A. | V(NaOH)=0时,c(H+)=1×10-2 mol/L | |
| B. | V(NaOH)=10mL时,c(H+)=1×10-7 mol/L | |
| C. | V(NaOH)<10mL时,可能存在c(Na+)=2c(C2O42-)+c(HC2O4-) | |
| D. | V(NaOH)>10mL时,c(C2O42-)>c(Na+)>c(HC2O4-) |
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.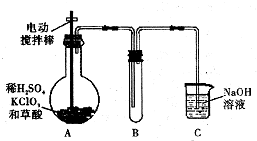 ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.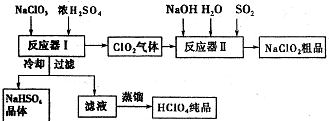
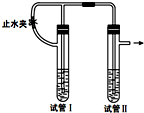 在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.
在如图装置中,用NaOH溶液、铁屑、稀硫酸等试剂制备Fe(OH)2.