题目内容
8.下列说法正确的是( )| A. | 在酸性条件下,CH3CO18OC2H5水解的产物是CH3CO18OH和C2H5OH | |
| B. | 用甘氨酸(H2NCH2COOH)和丙氨酸(CH3CHNH2COOH)混合缩合,最多可形成3种二肽 | |
| C. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| D. | 将电石与饱和食盐水反应生成的气体通入溴的四氯化碳溶液中,若溶液褪色,证明有乙炔生成 |
分析 A.酯化反应时羧酸脱-OH,醇脱H;
B.氨基酸形成肽键原理为羧基提供-OH,氨基提供-H,两个氨基酸分子脱去一个水分子脱水结合形成二肽,既要考虑不同氨基酸分子间生成二肽,又要考虑同种氨基酸分子间形成二肽;
C.苯甲酸与CaO反应后,增大与苯甲醛的沸点差异;
D.生成的气体中有乙炔、硫化氢等,均与溴反应.
解答 解:A.酯化反应时羧酸脱-OH,醇脱H,则在酸性条件下,CH3CO18OC2H5水解的产物是CH3COOH和C2H518OH,故A错误;
B.当同种氨基酸脱水,生成2种二肽;当是异种氨基酸脱水:可以是甘氨酸脱去羟基,丙氨酸脱氢;也可以丙氨酸脱羟基,甘氨酸脱去氢,生成2种二肽,共4种,故B错误;
C.苯甲酸与CaO反应后,增大与苯甲醛的沸点差异,然后蒸馏可分离,故C正确;
D.生成的气体中有乙炔、硫化氢等,均与溴反应,若溶液褪色,不能证明有乙炔生成,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系、有机物的鉴别及鉴别等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
18.下列离子方程式错误的是( )
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
19.表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
涉及到填写的物质写元素符号或化学式
(1)写出②号形成的单质的电子式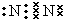 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar
(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是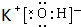 .
.
(3)单质硬度最大的元素是C其氢化物结构式为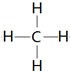 .
.
(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物: ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(1)写出②号形成的单质的电子式
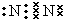 ,在这些元素中,化学性质最不活泼的是:Ar
,在这些元素中,化学性质最不活泼的是:Ar(2)在最高价氧化物的水化物中,酸性最强的化合物的化学式是HClO4,碱性最强的化合物的电子式是
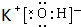 .
.(3)单质硬度最大的元素是C其氢化物结构式为
 .
.(4)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应离子方程式Al2O3+2OH-=2AlO2-+H2O.
(5)用电子式表示元素④与⑥形成的化合物:
 ,该化合物属于离子 (填“共价”或“离子”)化合物.
,该化合物属于离子 (填“共价”或“离子”)化合物.
16.下列说法或表示方法正确的是( )
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是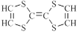 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为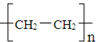 |
13.下列反应的离子方程式书写正确的是( )
| A. | 石灰石与盐酸反应:CO32-+2H+=H2O+CO2↑ | |
| B. | 氯化铝溶液与氨水反应:Al3++3OH-=Al(OH)3↓ | |
| C. | 铁粉与硝酸银溶液反应:Fe+3Ag+=Fe3++3Ag | |
| D. | 醋酸与氢氧化钠溶液反应:CH3COOH+OH-=CH3COO-+H2O |
 2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.
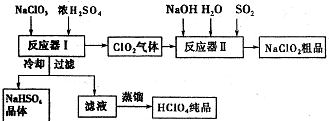
2015年,“雾霾”成为年度关键词.近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题.雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成.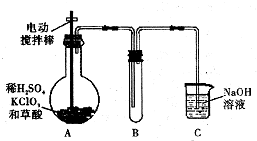 ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.
ClO2是一种高效水处理剂,某实验小组用下图所示装置制取并收集Cl02.已知:①ClO2为黄绿色气体,极易溶于水,熔点-59C,沸点11℃,具有强氧化性.