题目内容
四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别是1:
,1:1,1:2和1:3.
据此回答下列问题:
(1)仅根据上述信息就能够确定的元素是 (选填A、B、C、D).
(2)在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式) ;由A、D两元素构成的化合物A2D2的电子式为(用元素符号填写,下同) .
(3)写出所有满足上述信息的化合物CD2与化合物A2D2反应的化学方程式: ;
(4)在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物m g,在一定条件下与过量氧气反应后,将产物通过足量的固体A2D2,最终发现固体质量增重为m g,则符合此条件的X的分子组成可用通式( )x?( )y 来表示.
| 1 |
| 3 |
据此回答下列问题:
(1)仅根据上述信息就能够确定的元素是
(2)在所有满足上述信息的短周期元素中,最高价氧化物的水化物酸性最强的是(填化学式)
(3)写出所有满足上述信息的化合物CD2与化合物A2D2反应的化学方程式:
(4)在满足上述信息的短周期元素中,若B2、CD和由B、C、D形成的化合物X的混合物m g,在一定条件下与过量氧气反应后,将产物通过足量的固体A2D2,最终发现固体质量增重为m g,则符合此条件的X的分子组成可用通式(
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别是1:
、1:1、1:2、1:3,则A为第三周期第IA族元素,为Na元素;B为H、Be或Al;C为He、C或S元素;D为O元素,
(1)根据已经推断的元素判断;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;由A、D两元素构成的化合物A2D2为Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;
(3)化合物CD2与化合物Na2O2能发生反应,则CD2为CO2或SO2,二氧化碳、二氧化硫都能和过氧化钠发生氧化还原反应;
(4)在满足上述信息的短周期元素中,能组成B2、CD,且能与氧气反应后产物再与过氧化钠反应的,B应为氢元素,C为碳元素,即由CO和H2与氧气反应生成水和二氧化碳,再由过氧化钠与水及二氧碳反应,生成氢氧化钠和碳酸钠,根据化学式差异确定X分子构成.
| 1 |
| 3 |
(1)根据已经推断的元素判断;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外;由A、D两元素构成的化合物A2D2为Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键;
(3)化合物CD2与化合物Na2O2能发生反应,则CD2为CO2或SO2,二氧化碳、二氧化硫都能和过氧化钠发生氧化还原反应;
(4)在满足上述信息的短周期元素中,能组成B2、CD,且能与氧气反应后产物再与过氧化钠反应的,B应为氢元素,C为碳元素,即由CO和H2与氧气反应生成水和二氧化碳,再由过氧化钠与水及二氧碳反应,生成氢氧化钠和碳酸钠,根据化学式差异确定X分子构成.
解答:
解:四种短周期元素A、B、C、D,它们原子的电子层数与最外层电子数之比分别是1:
、1:1、1:2、1:3,则A为第三周期第IA族元素,为Na元素;B为H、Be或Al;C为He、C或S元素;D为O元素,
(1)根据以上分析知,A、D两种元素能确定,故答案为:AD;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,这些元素中非金属性最强的是S(O元素除外)元素,所以酸性最强的是H2SO4;由A、D两元素构成的化合物A2D2为Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,电子式为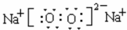 ,
,
故答案为:H2SO4;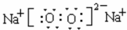 ;
;
(3)化合物CD2与化合物Na2O2能发生反应,则CD2为CO2或SO2,二氧化碳、二氧化硫都能和过氧化钠发生氧化还原反应,反应方程式分别为:2Na2O2+2CO2=2Na2CO3+O2、Na2O2+SO2=Na2SO4,故答案为:2Na2O2+2CO2=2Na2CO3+O2、Na2O2+SO2=Na2SO4;
(4)在满足上述信息的短周期元素中,能组成B2、CD,且能与氧气反应后产物再与过氧化钠反应的,B应为氢元素,C为碳元素,即由CO和H2与氧气反应生成水和二氧化碳,再由过氧化钠与水及二氧碳反应,生成氢氧化钠和碳酸钠,比较Na2O2与Na2CO3、NaOH组成可以知道,要使CO和H2以及CO、H2的混合气体的质量与Na2O2与增重质量相等,则CO和H2以及CO、H2的混合气体的组成必需满足(CO)x?(H)y.(或:(H)x?(CO)y或(CO)x?(H2)y等形式,故答案为:CO;H2.
| 1 |
| 3 |
(1)根据以上分析知,A、D两种元素能确定,故答案为:AD;
(2)元素的非金属性越强,其最高价氧化物的水化物酸性越强,但O、F元素除外,这些元素中非金属性最强的是S(O元素除外)元素,所以酸性最强的是H2SO4;由A、D两元素构成的化合物A2D2为Na2O2,过氧化钠中钠离子和过氧根离子之间存在离子键、O原子之间存在共价键,电子式为
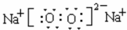 ,
,故答案为:H2SO4;
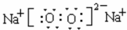 ;
;(3)化合物CD2与化合物Na2O2能发生反应,则CD2为CO2或SO2,二氧化碳、二氧化硫都能和过氧化钠发生氧化还原反应,反应方程式分别为:2Na2O2+2CO2=2Na2CO3+O2、Na2O2+SO2=Na2SO4,故答案为:2Na2O2+2CO2=2Na2CO3+O2、Na2O2+SO2=Na2SO4;
(4)在满足上述信息的短周期元素中,能组成B2、CD,且能与氧气反应后产物再与过氧化钠反应的,B应为氢元素,C为碳元素,即由CO和H2与氧气反应生成水和二氧化碳,再由过氧化钠与水及二氧碳反应,生成氢氧化钠和碳酸钠,比较Na2O2与Na2CO3、NaOH组成可以知道,要使CO和H2以及CO、H2的混合气体的质量与Na2O2与增重质量相等,则CO和H2以及CO、H2的混合气体的组成必需满足(CO)x?(H)y.(或:(H)x?(CO)y或(CO)x?(H2)y等形式,故答案为:CO;H2.
点评:本题考查位置结构性质的相互关系及应用,涉及氧化还原反应、电子式的书写、酸性强弱判断等知识点,综合性较强,侧重考查分析、推断及应用能力,正确判断元素是解本题关键,难点是(4)题,正确分析能使过氧化钠质量增加的实质性物质即可解答,题目难度中等.

练习册系列答案
 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案
相关题目
“封管实验”具有简易、方便、节约、绿色等优点,观察下面四个“封管实验”(夹持装置未画出),判断下列说法正确的是( )


| A、加热时,③溶液变红,冷却后又变为无色 |
| B、加热时,②溶液变红,冷却后又变为无色 |
| C、加热时,①上部汇集了固体NH4Cl,说明NH4Cl的热稳定性比较好 |
| D、四个“封管实验”中所发生的化学反应都是可逆反应 |
下列说法正确的是( )
| A、含碳元素的化合物都是有机物 |
| B、完全燃烧只生成CO2和H2O的化合物都是烃 |
| C、大多数有机物分子中碳原子与碳原子之间或碳原子与其他原子之间相结合的化学键是非极性共价键和极性共价键 |
| D、有机物完全燃烧只可能生成CO2和H2O |
 如图甲为用氢气还原氧化铜的微型快速实验装置,实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的小匙,将铜丝2一段弯曲成螺旋状,试回答下列问题:
如图甲为用氢气还原氧化铜的微型快速实验装置,实验前先将铜丝1处理成下端弯曲的一小圆环,并用铁锤锤击成带小孔的小匙,将铜丝2一段弯曲成螺旋状,试回答下列问题: 已知I、II反应在一定条件节焓变及平衡常数如下:
已知I、II反应在一定条件节焓变及平衡常数如下: