题目内容
18.${\;}_{55}^{137}$Cs是核反应堆的常见放射性副产物,${\;}_{55}^{137}$Cs能自发转化为${\;}_{56}^{137}$Ba,同时放出射线.下列有关叙述正确的是( )| A. | ${\;}_{55}^{137}$Cs与${\;}_{56}^{137}$Ba互为同位素 | |
| B. | ${\;}_{55}^{137}$Cs与${\;}_{56}^{137}$Ba中子数相等 | |
| C. | ${\;}_{56}^{137}$Ba原子最外层电子数为2 | |
| D. | Ba比Cs更容易失去电子 |
分析 A.质子数相同中子数不同的同一元素互称同位素;
B.元素符号左下角的数字表示原子的质子数,左上角的数字表示原子的中子数与质子数之和即质量数,中子数=质量数-质子数;
C.处于ⅡA族的元素最外层电子数为2;
D.同一周期从左向右,金属性减弱.
解答 解:A.${\;}_{55}^{137}$Cs与${\;}_{56}^{137}$Ba质子数分别为55、56,质子数不相同,不是同位素,故A错误;
B.中子数=质量数-质子数,${\;}_{55}^{137}$Cs与${\;}_{56}^{137}$Ba 中子数分别为137-55=82、137-56=81,中子数不相同,故B错误;
C.Ba元素处于第ⅡA族,其最外层电子数为2,故C正确;
D.Ba、Cs同处在第六周期,钡位于铯的右边,同一周期从左向右,金属性减弱,所以Ba比Cs更难失去电子,故D错误;
故选C.
点评 本题考查元素在周期表中的位置及元素的性质,注意质子数、中子数和质量数的关系即可解答,并注意元素周期律的应用来解答,题目难度不大.

练习册系列答案
相关题目
3.对于某些离子的检验及结论一定正确的是( )
| A. | 加入硝酸酸化的硝酸银溶液,有白色沉淀产生,一定有Cl- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液并加热,产生的气体能使湿润蓝色石蕊试纸变红,一定有NH4+ | |
| D. | 用铂丝蘸取某溶液在酒精灯火焰上灼烧,火焰呈黄色,说明原溶液中一定不含有K+ |
6.设NA表示阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 由2H和18O所组成的水11g,其中所含的中子数为5NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| C. | 常温常压下,48gO2和O3混合气含有的氧原子数为3NA | |
| D. | 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子数均约为0.2NA |
3. 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
 向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )
向盛有50mL 1.00mol•L-1 HCl溶液的绝热容器中加入NaOH溶液,NaOH溶液的体积(V)与所得混合溶液的最高测量温度(T)的关系如图所示,下列叙述中不正确的是( )| A. | 该实验表明化学能可以转化为热能 | |
| B. | NaOH溶液的浓度大于1.00 mol•L-1 | |
| C. | V=50 mL时,混合液呈碱性 | |
| D. | 该实验表明有水生成的反应都是放热反应 |
10.下列物质中,能够导电的电解质是( )
| A. | 氨水 | B. | 蔗糖 | C. | 铜导线 | D. | 熔融的KCl |
7.依据元素周期表及元素周期律,下列推断中正确的是( )
| A. | 同一周期元素的原子,半径越小越容易失去电子 | |
| B. | ⅠA族元素的金属性比ⅡA族元素的金属性强 | |
| C. | 若M+和R2-的核外电子层结构相同,则原子序数:R<M | |
| D. | 主族元素的最高正化合价等于该元素原子的核外电子数 |
8.某元素的原子结构示意图为 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )
 ,有关该元素的说法中,错误的是( )
,有关该元素的说法中,错误的是( )| A. | 原子的核内质子数为17 | B. | 原子的核外有3个电子层 | ||
| C. | 原子的最外层电子数为7 | D. | 属于金属元素 |
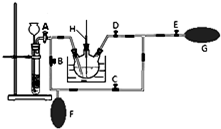 高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.
高锰酸钾是一种用途广泛的强氧化剂,实验室制备高锰酸钾所涉及的化学方程式如下:MnO2熔融氧化:3MnO2+KClO3+6KOH $\frac{\underline{\;熔融\;}}{\;}$3K2MnO4+KCl+3H2O;K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3.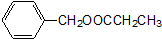 )是其中的一种,它可以从茉莉花中提取,也可以人工合成.一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取,也可以人工合成.一种合成路线如下: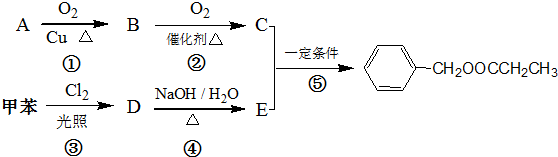
 .
.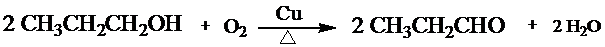 ,④
,④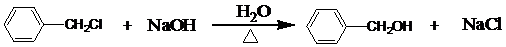
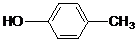
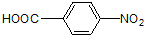 )的流程图;(示例:CH3CH2OH$→_{Cu△}^{O_{2}}$CH3CHO)
)的流程图;(示例:CH3CH2OH$→_{Cu△}^{O_{2}}$CH3CHO)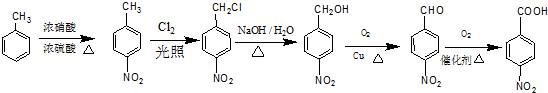 .
.