题目内容
下列叙述正确的是( )
| A、某酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则a≤b-1 |
| B、在滴酚酞溶液的氨水中,加入NH4Cl至溶液恰好无色,则此时溶液的c (NH4+)=c(Cl-) |
| C、常温下,某硫酸溶液的pH=3,升高其温度,溶液pH增大 |
| D、相同温度、相同体积、相同物质的量浓度的KI和KF溶液中,离子总数前者大于后者 |
考点:弱电解质在水溶液中的电离平衡
专题:
分析:A、根据弱电解质的电离平衡来分析稀释后的pH;
B、根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
C、pH=3的强酸溶液,加热不影响氢离子浓度;
D、根据电荷守恒,c(I-)+c(OH-)=c(K+)+c(H+),c(F-)+c(OH-)=c(K+)+c(H+)分析.
B、根据离子对氨水的电离平衡的影响来分析平衡移动及溶液的pH;
C、pH=3的强酸溶液,加热不影响氢离子浓度;
D、根据电荷守恒,c(I-)+c(OH-)=c(K+)+c(H+),c(F-)+c(OH-)=c(K+)+c(H+)分析.
解答:
解:A、若酸是弱酸,稀释时促进电离,但氢离子的浓度减小,将pH=a的溶液稀释10倍后,则pH变大,即a+1>b>a,故A错误;
B、溶液的c (NH4+)=c(Cl-)说明溶液显中性,在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定等于7,故B错误;
C、pH=3的强酸溶液,加热不影响氢离子浓度,其pH不变,故C错误;
D、根据电荷守恒,c(I-)+c(OH-)=c(K+)+c(H+),c(F-)+c(OH-)=c(K+)+c(H+),即离子总数是n(K+ )+n(H+)的2倍,而KF水解显碱性,KI不水解显中性,即KF溶液中的c(OH-)大,c(H+)小,c(K+)相同,所以KI中离子浓度大,故D正确.
故选D.
B、溶液的c (NH4+)=c(Cl-)说明溶液显中性,在氨水中存在电离平衡,当加入NH4Cl,平衡逆向移动,氢氧根离子的浓度减小,由酚酞的变色范围8.2~10可知,此时溶液的pH可能小于8.2,不一定等于7,故B错误;
C、pH=3的强酸溶液,加热不影响氢离子浓度,其pH不变,故C错误;
D、根据电荷守恒,c(I-)+c(OH-)=c(K+)+c(H+),c(F-)+c(OH-)=c(K+)+c(H+),即离子总数是n(K+ )+n(H+)的2倍,而KF水解显碱性,KI不水解显中性,即KF溶液中的c(OH-)大,c(H+)小,c(K+)相同,所以KI中离子浓度大,故D正确.
故选D.
点评:本题考查了电离平衡及pH的有关计算,能利用影响平衡的因素及酸碱反应的实质来分析解答即可,易错选项是D,注意从电荷守恒的角度解答该题..

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
有标准状况下24mL H2和O2的混合气体,在一定条件下点燃后恢复到原状态仅剩余3mL气体(该气体可使带火星木条复燃),则原混合气体中H2和O2的分子个数之比为( )
| A、1:16 | B、16:1 |
| C、17:7 | D、7:5 |
等质量的镁和铝分别与足量的稀盐酸反应后,在相同状况下生成的气体的体积比是( )
| A、1:1 | B、4:3 |
| C、2:3 | D、3:4 |
下列各组内物质不论以任何比例混合,只要当混合物的质量一定时,混合物完全燃烧后生成的二氧化碳量不变的是( )
| A、甲苯和乙苯 | B、乙烯和丙烯 |
| C、乙烷和乙烯 | D、乙烯和苯 |
用下列装置进行相应实验,能达到实验目的是( )
A、 用图能证明酸性:硫酸>碳酸>次氯酸 |
B、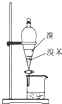 用图所示装置分离出溴苯 |
C、 用图设计成铜锌原电池装置 |
D、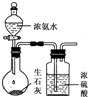 用图制取干燥的氨气 |
下列仪器:①漏斗 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥烧杯 ⑦试管,常用于物质分离的是( )
| A、①③④ | B、①②⑥ |
| C、①③⑤ | D、③④⑦ |
下列有关电解质溶液中粒子浓度关系正确的是( )
| A、pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B、含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C、CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D、NaHCO3溶液:c(H+)+c(HCO3-)+c(CO32-)=c(OH-) |