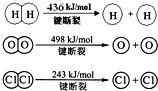
题目内容
在0.1mol?L-1的CH3COOH溶液中存在如下电离平衡CH3COOH?CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
| A、加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大 | ||
| B、滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | ||
| C、加入少量Na2CO3固体,平衡不移动 | ||
D、加水稀释,可使溶液中
|
考点:弱电解质在水溶液中的电离平衡
专题:电离平衡与溶液的pH专题
分析:A、加入冰醋酸,醋酸电离度减小;
B、加入盐酸氢离子浓度增大;
C、碳酸根离子能够与氢离子反应,导致氢离子浓度减小;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、H+个数增加.
B、加入盐酸氢离子浓度增大;
C、碳酸根离子能够与氢离子反应,导致氢离子浓度减小;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、H+个数增加.
解答:
解:A、加入冰醋酸,醋酸电离度减小,故A错误;
B、向0.1mol?L-1的CH3COOH溶液中加少量0.1mol/LHCl,氢离子浓度增大,故B错误;
C、碳酸根离子能够与氢离子反应,导致氢离子浓度减小,醋酸的电离平衡正向移动,故C错误;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、H+个数增加,所以
变大,故D正确;
故选D.
B、向0.1mol?L-1的CH3COOH溶液中加少量0.1mol/LHCl,氢离子浓度增大,故B错误;
C、碳酸根离子能够与氢离子反应,导致氢离子浓度减小,醋酸的电离平衡正向移动,故C错误;
D、加水稀释促进CH3COOH电离,溶液中CH3COOH个数减少、H+个数增加,所以
| c(H+) |
| c(CH3COOH) |
故选D.
点评:本题考查了弱电解质的电离,明确弱电解质电离特点及影响弱电解质电离的因素即可解答,注意D中采用其个数变化判断浓度之比变化,题目难度不大.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案
相关题目
下列各种环境下的离子组合能够大量共存的是( )
| A、中性溶液中,Na+、Fe3+、SO42-、ClO- |
| B、pH=0的溶液中,Al3+、NH4+、Ca2+、SO42- |
| C、c(H+)=1.0×10-14mol?L-1的溶液中,Na+、AlO2-、S2-、SO32- |
| D、石蕊试纸变红的溶液中,Fe2+、I-、NO3-、ClO- |