题目内容
已知:反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol
请回答:
(1)H2与O2反应生成气态水的热化学方程式是 .
(2)断开1mol H-O 键所需能量约为 kJ.
H2(g)+Cl2(g)=2HCl(g)△H=-184kJ/mol

请回答:
(1)H2与O2反应生成气态水的热化学方程式是
(2)断开1mol H-O 键所需能量约为
考点:热化学方程式,有关反应热的计算
专题:
分析:(1)根据盖斯定律来解答;
(2)依据反应热=拆化学键吸收的能量-形成化学键放出的能量来解答.
(2)依据反应热=拆化学键吸收的能量-形成化学键放出的能量来解答.
解答:
解:(1)①H2(g)+Cl2(g)═2HCl(g)△H=-184kJ/mol
②4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
根据盖斯定律①×2+②得:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
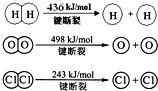
(2)2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ,
故答案为:463.4.
②4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)△H=-115.6kJ/mol
根据盖斯定律①×2+②得:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,
故答案为:2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol;
(2)2H2(g)+O2(g)=2H2O(g)△H=-483.6 kJ/mol,△H=断裂化学键吸收的能量-形成化学键放出的能量=2×436KJ+498KJ-4×H-O=-483.6 kJ,则得到H-O的键能=463.4kJ,
故答案为:463.4.
点评:本题考查了盖斯定律的应用,键能计算焓变的方法,难度不大.

练习册系列答案
相关题目
下列说法正确的是( )
| A、原子和其它原子形成共价键时,其共价键数一定等于原子的价电子数 |
| B、离子化合物中只有离子键,共价化合物中只有共价键 |
| C、铵根离子呈正四面体结构 |
| D、氨分子中氢原子、氮原子的化合价已饱和,不能再与其它原子或离子成键 |
同温同压下,等质量的SO2和CO2相比较,下列叙述正确的是( )
| A、密度比为16:11 |
| B、密度比为11:16 |
| C、体积比为1:1 |
| D、体积比为11:16 |
室温下,pH相同体积相同的醋酸和盐酸两种溶液分别采取下列措施,有关叙述正确的是( )
| A、加水稀释2倍后,两溶液的pH均减小 |
| B、使温度都升高20℃后,两溶液的pH均不变 |
| C、加适量的醋酸钠晶体后,两溶液的pH均增大 |
| D、加足量的锌充分反应后,醋酸产生的氢气比盐酸少 |
在0.1mol?L-1的CH3COOH溶液中存在如下电离平衡CH3COOH?CH3COO-+H+ 对于该平衡,下列叙述正确的是( )
| A、加入少量冰醋酸,溶液的pH减小,CH3COOH的电离度增大 | ||
| B、滴加少量0.1mol/LHCl溶液,溶液中C(H+)减少 | ||
| C、加入少量Na2CO3固体,平衡不移动 | ||
D、加水稀释,可使溶液中
|
实验证明:若用电解熔融KCl制钾,发现钾熔于熔融KCl中难分离,且电解过程中容易发生爆炸事故等.因而工业不用电解熔融KCl制钾,而用金属钠与KCl共熔置换制钾:
Na(l)+KCl(l)?NaCl(l)+K(g)△H>0. 下面是四种物质的熔沸点:
根据平衡移动原理,可推知用Na与KCl反应制取金属钾的适宜温度是( )
Na(l)+KCl(l)?NaCl(l)+K(g)△H>0. 下面是四种物质的熔沸点:
| K | Na | KCl | NaCl | |
| 熔点/℃ | 63.6 | 97.8 | 770 | 801 |
| 沸点/℃ | 774 | 882.9 | 1500 | 1413 |
| A、低于770℃ |
| B、约850℃? |
| C、高于882.9℃ |
| D、1413~1500℃? |
下列说法正确的是( )
| A、若原子X的质子数为a,则X的质量数一定不为a |
| B、若两种元素形成的离子M2-和N+电子层结构相同,则离子半径M2->N+ |
| C、同周期非金属氧化物对应水化物酸性从左到右依次增强 |
| D、由两种元素组成的化合物,若含有离子键,就没有共价键 |