��Ŀ����
6��ʵ�����Ʊ����ռ������ SO2������������ͼ��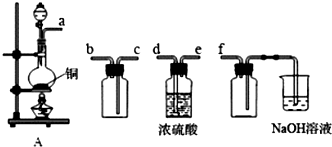
��1��װ��A����SO2���������������Ӹ������ӿڣ�˳��Ϊ a��d��e��c��b��f��
��2����֤������������ SO2�ķ�����ʵ�������ǽ�����ͨ��Ʒ����Һ�У����Ʒ����ɫ�����Ⱥ��ָֻ���ɫ��
��3������1L 0.3mol/L�� NaOH��Һ�У�ͨ��4.48L SO2�����������Ӧ��������Һ������Ũ��֮����һЩ������ϵ�����磺c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-��������д������������ϵ��2c��Na+��=3c��HSO3-��+3c��SO32-��+3c��H2SO3����c��SO32-��+c��HSO3-��+c��H2SO3��=0.2mol/L��c��HSO3-��+3c��H2SO3��+2c��H+��=c��SO32-��+2c��OH-����
���� ��1������ʵ�����������ӣ�ͭ��Ũ������ȷ�Ӧ��������ͭ�����������ˮ����ȫƿ��ʹ���Լ�β��������������
��2�������������֤����������������Ư������������������������Ʒ����ɫ�����Ȼָ���ɫ��
��3��n��NaOH��=0.3mol/L��1L=0.3mol��n��SO2��=$\frac{4��48L}{22.4L/mol}$=0.2mol��������Na2SO3��NaHSO3�����ʵ����ֱ���xmol��ymol������Na��Sԭ���غ��x+y=0.22x+y=0.3��ã�x=0.1mol��y=0.1mol��������Һ�е������ǵ����ʵ�����Na2SO3��NaHSO3����Һ�д��ڵ���غ㡢�����غ�������غ㣮
��� �⣺��1���ռ���������Ӧ�ȸ������ռ�������ͨ��d��e������������ܶȱȿ�����Ҫ��c�ڽ�����b�ڳ�������β����������Ϊ�������������������Ʒ�Ӧ����f�������ǰ�ȫƿ����ֹ������ʢ��NaOH��Һ���ձ�Ϊβ������װ��Ҫ���������װ��A����SO2���������������Ӹ������ӿڣ�˳��Ϊadecbf��
�ʴ�Ϊ��d��e��c��b��
��2��������������һ�㷽���ǽ�����ͨ��Ʒ����Һ�У����Ʒ����ɫ�����Ⱥ��ָֻ���ɫ��֤���ж�������
�ʴ�Ϊ��������ͨ��Ʒ����Һ�У����Ʒ����ɫ�����Ⱥ��ָֻ���ɫ��
��3��n��NaOH��=0.3mol/L��1L=0.3mol��n��SO2��=$\frac{4��48L}{22.4L/mol}$=0.2mol��
������Na2SO3��NaHSO3�����ʵ����ֱ���xmol��ymol��
����Na��Sԭ���غ��
x+y=0.22
x+y=0.3
��ã�x=0.1mol��
y=0.1mol��
������Һ�е������ǵ����ʵ�����Na2SO3��NaHSO3����Һ�д��ڵ���غ㡢�����غ�������غ㣬
���ݵ���غ��c��Na+��+c��H+��=c��HSO3-��+2c��SO32-��+c��OH-����
���������غ��2c��Na+��=3c��HSO3-��+3c��SO32-��+3c��H2SO3��]����c��SO32-��+c��HSO3-��+c��H2SO3��=0.2mol/L��
���������غ��c��HSO3-��+3c��H2SO3��+2c��H+��=c��SO32-��+2c��OH-����
�ʴ�Ϊ��2c��Na+��=3c��HSO3-��+3c��SO32-��+3c��H2SO3����c��SO32-��+c��HSO3-��+c��H2SO3��=0.2mol/L��c��HSO3-��+3c��H2SO3��+2c��H+��=c��SO32-��+2c��OH-����
���� ���⿼���������ʵ�����Ʒ�������ˮ�⡢����Ũ�ȴ�С�Ƚϡ�������ʵĵ����֪ʶ�㣬���ؿ���������ۣ�Ҫ�������շ�Ӧԭ��������װ�õ�ѡ���ռ�װ�õ�ѡ����Ŀ�Ѷ��еȣ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�| A�� | �������Ȼ�̼ | B�� | �Ҵ������� | C�� | �������ϩ | D�� | ���;ƾ� |
| A�� | C2H4��C3H6һ������ͬϵ�� | |
| B�� | ����[��C6H10O5��n]����ά��[��C6H10O5��n]��Ϊͬ���칹�� | |
| C�� | ͬϵ��֮�仯ѧ�������ƣ��������ʵݱ� | |
| D�� | ͬ���칹��֮�仯ѧ�������ƣ��������ʵݱ� |
| A�� | Fe2O3��HCl��Ӧ | B�� | ����������ϡ���ᷴӦ | ||
| C�� | ����������ϡ�������� | D�� | ������CuSO4��Ӧ |
| A�� | ��������ˮ��Ӧ��Na+2H2O=Na++2OH-+H2�� | |
| B�� | ��NaOH��Һ�еμ�����AlCl3��Һ��Al3++3OH-=Al��OH��3�� | |
| C�� | ��Na2SiO3��Һ��ͨ�����CO2��SiO32-+CO2+H2O=H2SiO3��+CO32- | |
| D�� | ��NaHSO4��Ba��OH��2��Һ��������ԣ�2H++SO42-+Ba2++2OH-=BaSO4��+2H2O |
��1���������ƳɵĽ���ȼ�ϡ��ǽ�������ȼ�ϡ���������Ӧ�õ��������߿Ƽ�����λ������A��B����ȼ��ʱ���ų������ȣ�������ȼ�ϣ���֪A��BΪ������Ԫ�أ���ԭ�ӵĵ�һ�����ĵ��������±���ʾ��
| �����ܣ�kJ/mol�� | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |

��ACl2������A���ӻ�����Ϊsp�ӻ���ACl2�Ŀռ乹��Ϊֱ���Σ�
��2��Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
�������������ѻ��γɵĽ������У���ԭ�ӵ���λ��Ϊ8��
��д��һ����CN-��Ϊ�ȵ�����ĵ��ʵĵ���ʽ
 ��
�����������������[Fe��CN��6]4-�����B��
A�����ۼ� B���Ǽ��Լ� C����λ�� D���Ҽ� E���м�
��3��һ��Al-Fe�Ͻ�����徧����ͼ2��ʾ����ݴ˻ش��������⣺
��ȷ���úϽ�Ļ�ѧʽFe2Al��
����������ܶ�=�� g/cm3����˺Ͻ������������Feԭ��֮��ľ��루�ú��ѵĴ���ʽ��ʾ�����ػ���Ϊ$\root{3}{\frac{139}{2��{N}_{A}}}$cm��
| A�� | C2H6 | B�� | C3H6 | C�� | C4H8 | D�� | C5H10 |
| A�� | NH3 | B�� | CO2 | C�� | HCI | D�� | NaCl |