题目内容
10.工业上用洗净的废铜屑作原料来制备硝酸铜.下列设计路线符合“绿色化学”思想的是( )| A. | Cu+HNO3(浓)→Cu(NO3)2 | B. | Cu+HNO3(稀)→Cu(NO3)2 | ||
| C. | Cu $\stackrel{空气}{→}$CuO$\stackrel{HNO_{3}}{→}$ Cu(NO3)2 | D. | Cu$\stackrel{浓硫酸}{→}$CuSO4$\stackrel{Ba(NO_{3})_{2}}{→}$Cu(NO3)2 |
分析 为了节约原料和防止污染环境,则反应中消耗的原料少,且该反应中不生成有毒气体,以此来解答.
A.浓硝酸与铜反应生成污染性气体NO2;
B.稀硝酸与铜反应生成污染性气体NO;
C.铜与氧气反应生成CuO,与硝酸反应消耗硝酸最少,且没有生成污染性气体;
D.铜与浓硫酸反应生成污染性气体二氧化硫.
解答 解:A.Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,二氧化氮有毒而污染环境,所以不符合条件,故A不选;
B.3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,NO有毒会污染环境,所以不符合条件,故B不选;
C.2Cu+O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO、CuO+2HNO3=Cu(NO3)2+H2O,该反应中没有有毒气体生成,且能节约硝酸,所以符合条件,故C选;
D.Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O、CuSO4+Ba(NO3)2=BaSO4↓+Cu(NO3)2,该过程中生成有毒气体二氧化硫且浪费浓硫酸、硝酸钡,所以不符合条件,故D不选;
故选C.
点评 本题以硝酸铜制备考查实验方案评价,为高频考点,明确反应条件、反应物的量、反应生成物的性质即可解答,要注意结合节约、环保理念分析解答,题目难度不大.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
20.高铁酸钠(Na2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4氧化性更强、无二次污染的绿色水处理剂.工业制高铁酸钠的方法有如下两种:
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法不正确的是( )
湿法制备的主要离子反应为:2Fe(OH)3+3ClO-+4OH-═2FeO42-+3Cl-+5H2O,
干法制备的主要反应为:2FeSO4+6Na2O2═2Na2FeO4+2Na2O+2Na2SO4+O2↑
则下列有关说法不正确的是( )
| A. | Na2FeO4可氧化水中的H2S、NH3,生成的Fe(OH)3胶体还能吸附悬浮杂质 | |
| B. | 湿法中FeO42-是氧化产物;干法中O2也是氧化产物 | |
| C. | 干法中每生成1mol Na2FeO4,这个反应共转移4mol电子 | |
| D. | 高铁酸钠中铁显+6价,它在氧化还原反应中通常被还原 |
18.在合成氨反应中,将等物质的量的氮气和氢气充入一密闭容器中发生反应,测得 2min 内氨的平均反应速率为 2mol•L-1•min-1,2min 末 N2 的浓度为 7mol•L-1,则氢气的起始浓度为( )
| A. | 9mol•L-1 | B. | 6mol•L-1 | C. | 3mol•L-1 | D. | 2mol•L-1 |
19.用层析法分离Fe3+和Cu2+的实验中,层析操作后,要将滤纸放在盛有浓氨水的试剂瓶口.为增强效果,可在浓氨水中加入( )
| A. | 氢氧化钠 | B. | 浓盐酸 | C. | 水 | D. | 硫酸铵 |
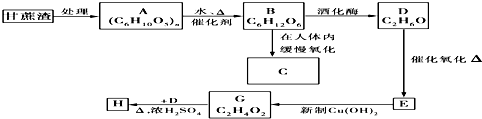
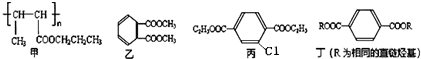
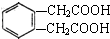 ;
;
 .
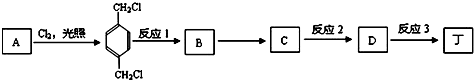
. 利用甲烷和氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如图所示,根据要求填空:
利用甲烷和氯气发生取代反应制取副产品盐酸的设想在工业上已成为现实.某化学兴趣小组通过在实验室中模拟上述过程,其设计的模拟装置如图所示,根据要求填空: