题目内容
1.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:方案Ⅰ:铜铝混合物$→_{充分反应}^{足量溶液A}$测定生成气体的体积
方案Ⅱ:铜铝混合物$→_{充分反应}^{足量溶液B}$测定剩余固体的质量
下列有关判断中不正确的是( )
| A. | 溶液A和B均可以是稀硫酸或NaOH溶液 | |
| B. | 若溶液B选用浓硝酸,则测得铜的质量分数偏大 | |
| C. | 溶液A和B均不可选用浓硝酸 | |
| D. | 实验室中方案Ⅱ更便于实施 |
分析 A.铜与稀硫酸或NaOH溶液不反应,铝与稀硫酸或NaOH溶液反应,剩余的固体为铜,根据生成的氢气可以计算混合物中铝的质量;
B.铝在浓硝酸中生成一层致密的氧化物保护膜,发生钝化现象,剩余固体的质量大于混合物中铝的质量,实际测量铜的质量减少;
C.硝酸与铜、铝都能反应;
D.测量气体的体积不如测量固体的质量简单易操作.
解答 解:A.铜与稀硫酸或NaOH溶液不反应,铝与稀硫酸或NaOH溶液反应,剩余的固体为铜,根据生成的氢气可以计算混合物中铝的质量,故溶液A和B均可以是稀硫酸或NaOH溶液,故A正确;
B.铝在浓硝酸中生成一层致密的氧化物保护膜,发生钝化现象,剩余固体的质量大于混合物中铝的质量,实际测量铜的质量减少,铜的含量降低,故B错误;
C.硝酸与铜、铝都能反应,不能用硝酸,故C正确;
D.测量气体的体积不如测量固体的质量简单易操作,故D正确.
故选B.
点评 本题考查学生对实验方案的理解与评价、元素化合物的性质等,难度中等,清楚物质的性质、理解实验方案原理是关键.

练习册系列答案
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案
相关题目
12.一定条件下,将等体积的NO和O2一同置于试管中,并将试管倒立于水中,充分反应后剩余气体的体积约为原气体体积的( )
| A. | $\frac{1}{8}$ | B. | $\frac{3}{8}$ | C. | $\frac{1}{4}$ | D. | $\frac{3}{4}$ |
9.把Na2O2投入FeCl2溶液中,可观察到的现象是( )
| A. | 生成白色沉淀 | B. | 生成红褐色沉淀 | C. | 无气泡产生 | D. | 无变化 |
16.化学与科学、技术、社会、环境密切相关,下列有关说法不正确的是( )
| A. | 含钙、钡、铂等金属的物质有绚丽的颜色,可用于制造焰火 | |
| B. | NO可用于某些疾病的治疗 | |
| C. | 盐碱地(含较多的NaCl、Na2CO3等)中施加适量石膏可降低土壤的碱性 | |
| D. | 雨后彩虹既是一种自然现象,又是一种光学现象,同时也与胶体有关 |
6.下列物质是纯净物的是( )
| A. | 铝热剂 | B. | 液氯 | C. | 植物油 | D. | 淀粉 |
13.已知: .若要合成
.若要合成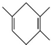 ,则所用的反应物可以是
,则所用的反应物可以是
①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔( )
 .若要合成
.若要合成 ,则所用的反应物可以是
,则所用的反应物可以是①2-甲基-1,3-丁二烯和2-丁炔 ②1,3-戊二烯和2-丁炔
③2,3-二甲基-1,3-戊二烯和乙炔 ④2,3-二甲基-1,3-丁二烯和丙炔( )
| A. | ①④ | B. | ①② | C. | ②④ | D. | ②③ |
10.25℃下,0.1mol/L的Na2S溶液,下列叙述正确的是( )
| A. | 升高温度,溶液的pH降低 | |
| B. | 加入NaOH固体,溶液中的c(Na+)、c(S2--)均增大 | |
| C. | c(Na+)>c(OH-)>c(S2--)>c(H+) | |
| D. | 2c(Na+)=c(S2--)+c(HS-)+c(H2S) |
11.制取相同质量的硝酸铜时,消耗硝酸质量最多的是( )
| A. | 铜与浓硝酸 | B. | 铜与稀硝酸 | ||
| C. | 氧化铜和硝酸反应 | D. | 氢氧化铜和硝酸反应 |