题目内容
12.下列反应的离子方程式,正确的是( )| A. | 铁和稀硝酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 铝与氢氧化钠溶液反应:Al+OH-═AlO2-+H2↑ | |
| C. | 醋酸跟碳酸氢钠溶液反应:HCO3-+H+═CO2↑+H2O | |
| D. | 氯气和水反应:Cl2+H2O═H++Cl-+HClO |
分析 A.铁与稀硝酸反应生成的是NO气体;
B.2mol铝与氢氧化钠溶液反应生成3mol氢气,该反应不满足电子守恒;
C.醋酸为弱酸,离子方程式中醋酸不能拆开;
D.氯气与水反应生成氯化氢和次氯酸,次氯酸需要保留分子式.
解答 解:A.铁和稀硝酸反应生成硝酸铁、NOs气体和水,正确的离子方程式为:Fe+4H++NO3-=Fe3++NO↑+2H2O,故A错误;
B.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,正确的离子方程式为:2Al+2H2O+2OH-═2AlO2-+3H2↑,故B错误;
C.醋酸跟碳酸氢钠溶液反应生成醋酸钠、二氧化碳气体和水,醋酸不能拆开,正确的离子方程式为:HCO3-+CH3COOH═CO2↑+H2O+CH3COO-,故C错误;
D.氯气和水反应生成HCl和HClO,反应的离子方程式为:Cl2+H2O═H++Cl-+HClO,故D正确;
故选D.
点评 本题考查了离子方程式的书写,题目难度不大,明确发生反应实质为解答关键,注意掌握离子方程式的书写原则,试题培养了学生的分析能力及规范答题能力.

练习册系列答案
相关题目
2.下列说法正确的是( )
| A. | 20℃,1.01×105Pa下 11.2LN2含有的分子数为3.01×1023 | |
| B. | 4℃时9mL水和标准状况下11.2L氮气含有相同的分子数 | |
| C. | 同温同压下,lmol NO与lmol N2和O2的混合气体的体积不相等 | |
| D. | 0℃、1.01×10sPa时,11.2L氧气所含的原子数目为3.01×1023 |
7.下列操作引起所配溶液浓度偏高的是( )
| A. | 容量瓶未干燥 | |
| B. | 定容时俯视液面 | |
| C. | 转移时有液体溅出 | |
| D. | 颠倒摇匀后发现液面低于刻度线,再加水至刻度线 |
17.由2个 、2个
、2个 、1个
、1个 和1个
和1个 构成的有机分子有(不考虑立体异构)( )
构成的有机分子有(不考虑立体异构)( )
 、2个
、2个 、1个
、1个 和1个
和1个 构成的有机分子有(不考虑立体异构)( )
构成的有机分子有(不考虑立体异构)( )| A. | 4种 | B. | 5种 | C. | 6种 | D. | 9种 |
4.硫酸锌可用于制造锌钡白、印染媒染剂等.用锌白矿(主要成分为ZnO,还含有Fe2O3、CuO、SiO2等杂成) 制备ZnSO4•7H2O的流程如图.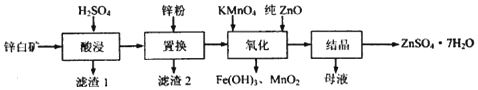
相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
(1)“滤渣1”的主要成分为SiO2(填化学式).“酸浸”过程中,提高锌元素浸出率的措施有:适当提高酸的浓度粉碎锌白矿(或充分搅拌浆料、适当加热等)(填一种).
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).

相关金属离了生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0mol•L-1计算)如表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
(2)“置换”过程中,加入适量的锌粉,除与溶液中的Fe3+,H+反应外,另一主要反应的化学方程式为Zn+CuSO4═Cu+ZnSO4.
(3)“氧化”一步中,发生反应的离子方程式为3Fe2++MnO4-+7ZnO+9H+═3Fe(OH)3+MnO2+7Zn2+.溶液PH控制在[3.2,6.4)之间的目的是使Fe3+沉淀完全,而Zn2+不沉淀MnO4-变为MnO2沉淀,避免引入杂质.
(4)“母液”中含有的盐类物质有ZnSO4、K2SO4(填化学式).
4.淀粉碘化钾试纸或溶液是实验室中的常用试剂.某中学化学兴趣小组用淀粉碘化钾溶液进行如下实验:
针对实验中出现的一些反常现象,需要设计实验进行探究:
(1)提出问题:
①实验1、实验2现象不同,猜想原因最有可能是二氧化碳参与氧气与碘离子的氧化反应;要证明该猜想是正确的,可以将用淀粉碘化钾溶液湿润的滤纸置于混有二氧化碳的氧气中,若滤纸变蓝,证明猜想正确.此过程中发生反应的离子方程式是2CO2+O2+4I-=2CO32-+2I2.
②实验3中溶液蓝色褪去的原因可能是
猜想一:氯气将碘单质氧化
猜想二:氯气将淀粉氧化
猜想三:氯气将碘单质和淀粉都氧化
(2)设计探究方案
要证明实验3褪色的原因是猜想一所致,可向褪色后的溶液中滴加少量碘水,若溶液变蓝色,即可证明.
(3)实验反思
查阅相关材料可知,氯所可将单质碘氧化为HIO3,酸性条件下,IO3-可被SO32-、I-还原为碘单质.其工业废水中的阴离子可能含有IO3-、I-中的一种或两种,要证明其中含有何种阴离子,你设计的实验方案是取废水少许于试管中,依次加入淀粉溶液和稀硫酸溶液,弱溶液变蓝色证明同时含有I-、IO3-离子,弱溶液不变蓝,在滴入KI溶液弱溶液变蓝色则证明含、IO3-离子,弱溶液不变蓝证明只含有I-(写出简单的实验步骤、现象和结论).发生反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O.
| 实验编号 | 1 | 2 | 3 |
| 实验步骤 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于空气中,观察现象 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于氧气中,观察现象 | 取少量淀粉碘化钾溶液置于试管中,通往足量的氯气,观察现象 |
| 实验现象 | 试纸缓慢变蓝 | 试纸不变蓝 | 溶液先变蓝后褪色 |
(1)提出问题:
①实验1、实验2现象不同,猜想原因最有可能是二氧化碳参与氧气与碘离子的氧化反应;要证明该猜想是正确的,可以将用淀粉碘化钾溶液湿润的滤纸置于混有二氧化碳的氧气中,若滤纸变蓝,证明猜想正确.此过程中发生反应的离子方程式是2CO2+O2+4I-=2CO32-+2I2.
②实验3中溶液蓝色褪去的原因可能是
猜想一:氯气将碘单质氧化
猜想二:氯气将淀粉氧化
猜想三:氯气将碘单质和淀粉都氧化
(2)设计探究方案
要证明实验3褪色的原因是猜想一所致,可向褪色后的溶液中滴加少量碘水,若溶液变蓝色,即可证明.
(3)实验反思
查阅相关材料可知,氯所可将单质碘氧化为HIO3,酸性条件下,IO3-可被SO32-、I-还原为碘单质.其工业废水中的阴离子可能含有IO3-、I-中的一种或两种,要证明其中含有何种阴离子,你设计的实验方案是取废水少许于试管中,依次加入淀粉溶液和稀硫酸溶液,弱溶液变蓝色证明同时含有I-、IO3-离子,弱溶液不变蓝,在滴入KI溶液弱溶液变蓝色则证明含、IO3-离子,弱溶液不变蓝证明只含有I-(写出简单的实验步骤、现象和结论).发生反应的离子方程式是IO3-+5I-+6H+=3I2+3H2O.
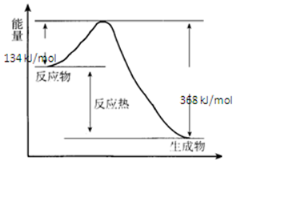 (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦.