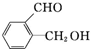
题目内容
11.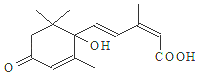 国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )
国庆期间对大量鲜花施用了S-诱抗素制剂,以保证鲜花盛开.S-诱抗素的分子结构如图,说法正确的是( )| A. | 分子式C15H21O4 | |
| B. | 既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1mol该物质与H2加成,最多消耗5molH2 | |
| D. | 既能使氯化铁溶液发生显色反应,又能使酸性高锰酸钾溶液褪色 |
分析 由结构简式可知分子式,分子中含碳碳双键、碳氧双键、-OH、-COOH,结合烯烃、醇、羧酸性质等来解答.
解答 解:A.由结构简式可知,该有机物的分子式为C15H20O4,故A错误;
B.含有羟基、羧基,可发生缩聚反应,含有碳碳双键,可发生加聚反应,故B正确;
C.只有碳碳双键、羰基与氢气发生加成反应,1mol该物质与H2加成,最多消耗4molH2,故C错误;
D.不含酚-OH,不能发生显色反应,故D错误;
故选B.
点评 本题考查有机物的结构与性质,为高频考点,把握结构中官能团与性质的关系为解答的关键,侧重烯烃、羧酸、醇性质的考查,题目难度不大.

练习册系列答案
相关题目
1.在一定条件下,按下列物质的量关系进行反应,其对应的离子方程式或化学方程式书写正确的是( )
| A. | n(Cl2):n(Fe)=5:4 5Cl2+4Fe$\frac{\underline{\;点燃\;}}{\;}$2FeCl2+2FeCl3 | |
| B. | n(Cl2):n(FeBr2)=1:1 Fe2++2Br-+Cl2=Fe3++Br2+2Cl- | |
| C. | n(MnO4-):n(H2O2)=2:3 2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O | |
| D. | n(Fe):n[HNO3(稀)]=1:3 4Fe+12H++3NO3-═3Fe2++Fe3++3NO↑+6H2O |
2.下列物质的水溶液能导电,但属于非电解质的是( )
| A. | CH3COOH | B. | Cl2 | C. | SO3 | D. | NH4HCO3 |
19.在298K,1.01×105Pa下•将22gCO2通入750mllmol/LNaOH溶液中充分反应,测得放出xkJ的热量.己知在该条件下,1molCO2通入1L2mol/LNaOH溶液中充分反应放出y kJ的热量.则CO2与NaOH溶液反应生成NaHCO3的热化学方程式是( )
| A. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2y-x)kJ/mol | |
| B. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(2x-y)kJ/mol | |
| C. | CO2 (g)+NaOH (aq)═NaHCO3 (aq)△H=-(4x-y)kJ/mol | |
| D. | 2CO2 (g)+2NaOH (1)═2NaHCO3 (1)△H=-(8x-2y)kJ/mol |
6.下列离子方程式正确的是( )
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
16.中和一定量的某醋酸溶液时,消耗氢氧化钠m g,如果先向该醋酸溶液中加入少量的醋,然后再用氢氧化钠中和,此时可消耗氢氧化钠n g,则m与n的关系为( )
| A. | m>n | B. | m<n | C. | m=n | D. | 无法确定 |
20.以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点.
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%.已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种.
①有关化学键键能数据如表中所示:
写出甲烷一步生成乙烯的热化学方程式2CH4(g)$\stackrel{催化剂}{→}$C2H4(g)+2H2(g)△H=+166.6kJ/mol,反应中硅化物晶格限域的单中心铁催化剂的作用是降低反应的活化能,加快反应的速率;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为81.25%;
③生成1mol Z产生的H2约合标准状况下179.2L.
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1).
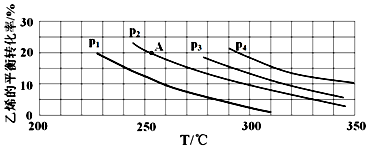
①若p2=8.0MPa,列式计算A点的平衡常数Kp=2.53(MPa)-1(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为放热(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9MPa,n(H2O):n(C2H4)=0.6:1.乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去,或增大水与乙烯的比例(任写两条).
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式C2H4-12e-+6CO32-=8CO2+2H2O.
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%.已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种.
①有关化学键键能数据如表中所示:
| 化学键 | H-H | C=C | C-C | C≡C | C-H |
| E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为81.25%;
③生成1mol Z产生的H2约合标准状况下179.2L.
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1).

①若p2=8.0MPa,列式计算A点的平衡常数Kp=2.53(MPa)-1(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为放热(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9MPa,n(H2O):n(C2H4)=0.6:1.乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去,或增大水与乙烯的比例(任写两条).
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式C2H4-12e-+6CO32-=8CO2+2H2O.
1.用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 24gNaH中阴离子所含电子总数为2NA | |
| B. | 标准状况下,44.8LNO与22.4LO2混合后,气体中分子总数为2NA | |
| C. | 在0.lmol/L的K2CO3溶液中,阴离子数目大于O.1NA | |
| D. | 300mL2mol/L乙醇溶液中所含分子数为0.6NA |
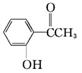 乙:
乙: ,丙:
,丙: