题目内容
15.某研究性学习小组查阅资料收集到如下信息:铁盐能蚀刻银而用来制作液晶显示器的银线路板.他们对蚀刻银的过程进行了探究.【实验1】制备银镜:
(1)ⅰ.配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水.并取等量银氨溶液于多支试管中.
ⅱ.向银氨溶液中加入等量的葡萄糖溶液,水浴加热.产生银镜,洗净,备用.
【实验2】溶解银镜:分别向两支试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液.
| 编号 | a | b |
| 试剂 | 0.1mol/L Fe(NO3)3 | 0.05mol/L Fe2(SO4)3 |
| 现象 | 银镜消失较快; 溶液黄色略变浅; 产生少许白色沉淀 | 银镜消失较慢; 溶液黄色明显变浅; 产生较多白色沉淀 |
(3)从a、b中均检出了Fe2+,说明Fe3+具有氧化性.a中Fe3+氧化Ag的离子方程式
是Fe3++Ag═Fe2++Ag+.
(4)确认b中沉淀为Ag2SO4(微溶),检验Ag2SO4固体中SO42-的方法是取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀.
(5)推测在a中的酸性条件下NO3-氧化了银,证据是a中溶液黄色略变浅,b中溶液黄色明显变浅.通过如下实验验证了推测是合理的:
ⅰ.测pH:测定实验a中所用Fe(NO3)3溶液的pH=2;
ⅱ.配制溶液:配制pH=2,c(NO3-)=0.3mol/L的溶液.取5mL此溶液加入有银镜的试管,现象是银镜消失,溶液颜色无明显变化.
请将步骤ⅱ补充完整.
(6)分析a中白色沉淀的成分,提出假设.
假设1:Fe(OH)2; 假设2:AgNO2; 假设3:…
①设计实验方案验证假设1:取少量沉淀置于空气中,未变色.假设1不成立.
②设计实验方案验证假设2(已知:亚硝酸盐能与酸化的KI溶液反应).
| 实验方案 | 预期现象和结论 |
分析 (1)硝酸银溶液中加氨水,至生成的沉淀恰好溶解可得到银氨溶液;
(2)对照试验中,0.1mol/L Fe(NO3)3和0.05mol/L Fe2(SO4)3中c(Fe3+)是一样的;
(3)Fe3+具有氧化性,金属银具有还原性,Fe3+氧化Ag得到亚铁离子和银离子;
(4)硫酸根离子可以和钡离子之间反应生成白色不溶于硝酸的沉淀硫酸钡,据此检验硫酸根离子;
(5)根据实验信息:a中溶液黄色略变浅,b中溶液黄色明显变浅得到实验结论;
(6)碘化银是一种黄色沉淀,结合亚硝酸盐能与酸化的KI溶液反应来判断沉淀的组成即可.
解答 解:(1)硝酸银溶液中加氨水,至生成的沉淀恰好溶解可得到银氨溶液,所以配制银氨溶液,需要的试剂是AgNO3溶液、稀氨水,故答案为:AgNO3溶液、稀氨水;
(2)分别向两支银镜的试管中加入5mL Fe(NO3)3、Fe2(SO4)3溶液,保证铁离子浓度相等的前提下,来判断银镜溶解的速度,故答案为:c(Fe3+);
(3)Fe3+具有氧化性,金属银具有还原性,Fe3+氧化Ag得到亚铁离子和银离子,即:Fe3++Ag═Fe2++Ag+,故答案为:Fe3++Ag═Fe2++Ag+;
(4)硫酸根离子可以和钡离子之间反应生成白色不溶于硝酸的沉淀硫酸钡,检验硫酸银中硫酸根离子的方法:取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀,
故答案为:取少量Ag2SO4固体于试管中,加入适量蒸馏水,振荡、静置,取上层清液,滴加Ba(NO3)2溶液,出现白色沉淀;
(5)根据选择的铁盐溶液铁离子浓度相等,但是盐溶液中的阴离子硝酸根离子和硫酸根离子的不同,单质银镜的溶解情况不同,a中溶液黄色略变浅,b中溶液黄色明显变浅,得到在a中的酸性条件下NO3-氧化了银,0.1mol/L Fe(NO3)3中,硝酸根离子是0.3mol/L,所以配制pH=2,c(NO3-)=0.3mol/L的溶液,结果银镜消失溶液的颜色无变化,说明铁离子没有参加反应,证明a中的酸性条件下NO3-氧化了银,
故答案为:a中溶液黄色略变浅,b中溶液黄色明显变浅;配制pH=2,c(NO3-)=0.3mol/L的溶液;银镜消失,溶液颜色无明显变化;
(6)碘化银是一种黄色沉淀,亚硝酸盐能与酸化的KI溶液反应产生黄色沉淀,亚硝酸具有氧化性,能将碘离子氧化,含有碘单质的溶液中滴加淀粉溶液后变蓝(或CCl4层显紫色),据此确定白色沉淀是否是亚硝酸银,故答案为:
| 实验方案 | 预期现象和结论 | |
| 方案 | 取少量白色沉淀,向其中加入过量酸化的KI溶液,静置,再向上层清液中滴加淀粉溶液(或取上层清液,加入CCl4后振荡、静置) | 加入酸化的KI溶液后产生黄色沉淀,上层清液滴加淀粉溶液后变蓝(或CCl4层显紫色),假设2成立 |
点评 本题考查了物质的组成实验设计和现象分析判断,题干信息的分析理解是解题关键,注意掌握物质性质,题目难度较大.

| A. | 碳与水反应吸收131.3 KJ的热量 | |
| B. | 1mol固态焦炭与1mol水蒸气反应产生一氧化碳和氢气,吸收131.3 KJ的热量 | |
| C. | 1mol碳和1mol水反应吸收131.3 KJ的热量 | |
| D. | 固态碳和气态水各1mol反应,放出131.3 KJ的热量 |
| A. | FeCl2溶液中通入Cl2:Fe2++Cl2→Fe3++2Cl- | |
| B. | AlCl3溶液呈酸性:Al3++3H2O→Al(OH)3+3H+ | |
| C. | Al2(SO4)3溶液加入过量的氨水:Al3++3 NH3•H2O→Al(OH)3↓+3NH4+ | |
| D. | NaOH溶液中滴加少量Ca(HCO3)2溶液:Ca2++HCO3-+OH-→CaCO3↓+H2O |
| A. | KNO3的溶解度高于NaCl | |
| B. | KNO3的溶解度低于NaCl | |
| C. | 含有多种杂质时,KNO3比NaCl更适合利用降温结晶(或重结晶)法进行提纯 | |
| D. | 含有多种杂质时,NaCl比KNO3更适合利用降温结晶(或重结晶)法进行提纯 |
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%.已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种.
①有关化学键键能数据如表中所示:
| 化学键 | H-H | C=C | C-C | C≡C | C-H |
| E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为81.25%;
③生成1mol Z产生的H2约合标准状况下179.2L.
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系(其中n(H2O):n(C2H4)=1:1).
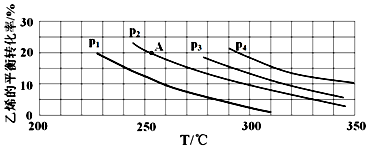
①若p2=8.0MPa,列式计算A点的平衡常数Kp=2.53(MPa)-1(用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为放热(填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为p1<p2<p3<p4,理由是反应分子数减少,相同温度下,压强升高乙烯转化率提高;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9MPa,n(H2O):n(C2H4)=0.6:1.乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有将产物乙醇液化移去,或增大水与乙烯的比例(任写两条).
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式C2H4-12e-+6CO32-=8CO2+2H2O.
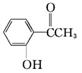 乙:
乙: ,丙:
,丙: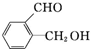
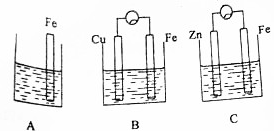 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.