题目内容
5.大气中的部分碘源于O3对海水中I-的氧化.将O3持续通入NaI酸性溶液中进行模拟研究.已知:①O3将I-氧化成I2的反应是:O3(g)+2I-(aq)+2H+(aq)═I2(aq)+O2(g)+H2O(l);
②在溶液中存在化学平衡:I2(aq)+I-(aq)?I3-(aq)△H

为探究温度对该反应的影响.在某温度T1下,将一定量的0.2mol•L-1NaI酸性溶液置于密闭容器中,并充入一定量的O3(不考虑生成物O2与 Iˉ反应),在t时刻,测得容器中I2(g)的浓度.然后分别在温度为T2、T3、T4、T5下,保持其它初始实验条件不变,重复上述实验,经过相同时间测得I2(g)浓度,得到趋势图(见图一).则:若在T3时,容器中无O3,则△H>0(填>、=或<);理由是根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),由于该反应是吸热反应,升高温度能使平衡I2(aq)+I-(aq)?I3-(aq),正向移动,从而使I2(aq)浓度减小,则△H>0.该条件下在温度为T4时,溶液中Iˉ浓度随时间变化的趋势曲线如图二所示.在t2时,将该反应体系温度上升到T5,并维持该温度.请在图2中画出t2时刻后溶液中 I-浓度变化总趋势曲线.
分析 在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+I-(aq)?I3-(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),由于该反应是吸热反应,升高温度能使平衡I2(aq)+I-(aq)?I3-(aq),正向移动,从而使I2(aq)浓度减小;
T4温度下I-转化浓度为0.11mol/L,转化率55%,由于该反应是吸热反应,升高温度能使平衡I2(aq)+I-(aq)?I3-(aq)正向移动,T5温度下I-的转化率为一定大于55%,I-的平衡浓度要小于0.04mol/L,所以拐点(平衡点)的位置坐标应在I-浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上.由此就可画出t2时刻后溶液中 Iˉ浓度变化总趋势曲线.
解答 解:在T3时,容器中已无O3,所以从图示可以知道,此时,溶液中只存在两个平衡:I2(ag)?I2(g),和 I2(aq)+Iˉ(aq)?I3ˉ(aq),根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),所以在不考虑其它因素时,I2(g)浓度会增加,但是从图2,T4→T5 所示的I2(g)浓度变化曲线看,实际上升高温度I2(g)浓度减少,那么只能判断是温度升高致使平衡I2(aq)+I-(aq)?I3-(aq) 正向移动,移动结果使I2(aq)浓度减小,从而导致I2(ag)?I2(g)平衡逆向移动,使I2(g)浓度减小,由此可以判断△H>0,
I2(aq)+I-(aq)?I3-(aq)是吸热反应.要画出t2时刻后溶液中 I-浓度变化总趋势曲线,必须首先确定曲线的起点、拐点和终点,已知图二所示的曲线是温度在T4时,溶液中Iˉ浓度随时间变化的趋势曲线,根由曲线分析可知反应己达到平衡,在t2时,反应体系温度上升到T5,并维持该温度,是改变的反应条件(升高温度),此时平衡必然会发生移动,所以T5温度下曲线的起点就是T4温度下曲线的终点,坐标位置应为(0.09,t2).由于升高温度加快反应速率,缩短达到平衡的时间,所以在T5温度下,达到平衡所用的时间要比T4温度下少,所以拐点出现所需时间比T4温度下少.由于该反应是吸热反应,升高温度能使平衡I2(aq)+I-(aq)?I3-(aq)正向移动,从而使Iˉ浓度减小.结合图三中的数据可知,T4温度下I-转化浓度为0.11mol/L,转化率为$\frac{(0.2-0.09)mol/L}{0.2mol/L}$=55%,所以T5温度下I-的转化率为一定大于55%,Iˉ的平衡浓度要小于0.09mol/L-(0.09mol/L×55%)≈0.04mol/L.所以拐点(平衡点)的位置坐标应在I-浓度小于0.04mol/L 处,终点与拐点(平衡点)在一条直线上.由此就可画出t2时刻后溶液中 I-浓度变化总趋势曲线为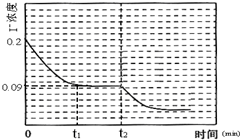 ,
,
故答案为:>;根据I2(ag)?I2(g)△H>0,升高温度,I2(ag)倾向于生成I2(g),由于该反应是吸热反应,升高温度能使平衡I2(aq)+I-(aq)?I3-(aq),正向移动,从而使I2(aq)浓度减小,则△H>0; .
.
点评 本题考查了转化率、化学反应与能量、化学平衡等知识点,题目难度中等,注意对图象进行分析找出解题的关键点.

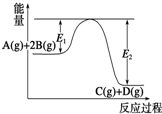
| A. | 该反应为放热反应 | |
| B. | 当反应达到平衡时,降低温度,A的转化率增大 | |
| C. | 压强增大,平衡向正反应方向移动 | |
| D. | 加入催化剂,反应速率增大,E1减小,E2减小,反应热减小 |
| A. | HS-+H2O?S2-+H3O+ | B. | SO3+H2O?HSO4-+H3O+ | ||
| C. | HCO3-+H2O?CO32-+H3O+ | D. | NH4++2H2O?NH3•H2O+H3O+ |
| 实验编号 | 0.01mol•L-1 酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 1mol•L-1 MnSO4溶液 | 反应温度 /℃ | 反应时间 |
| Ⅰ | 2mL | 2mL | 0mL | 0 | 20 | 125 |
| Ⅱ | 2mL | 1mL | 1mL | 0 | 20 | 320 |
| Ⅲ | 2mL | 2mL | 0mL | 0 | 50 | 30 |
| Ⅳ | 2mL | 2mL | 0mL | 2滴 | 20 | 10 |
(1)实验记时方法是从溶液混合开始记时,至溶液紫红色刚好褪去时记时结束.
(2)实验Ⅰ和Ⅱ研究浓度对反应速率的影响,实验Ⅰ和Ⅲ研究温度对反应速率的影响.请在上表空格中填入合理的实验数据.
(3)从实验数据分析,实验Ⅰ和Ⅳ研究催化剂对反应的影响.
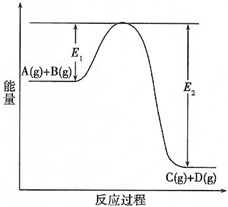
(4)在反应体系中加入催化剂,E1和E2的变化是:E1减小,E2减小(填“增大”、“减小”或“不变”,下同),反应速率增大,活化能减小,反应热不变.
| A. | 主要成分为NaCl、NaClO和NaHCO3 | B. | c(Cl-)=c(ClO-) | ||
| C. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)=c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-) |
 .
. .
.