题目内容
15.向含1mol Na2CO3的溶液中,通入0.5mol Cl2,得到含有NaClO的溶液,有关该溶液的说法中,正确的是( )| A. | 主要成分为NaCl、NaClO和NaHCO3 | B. | c(Cl-)=c(ClO-) | ||
| C. | 2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | D. | c(Na+)=c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-) |
分析 含1mol Na2CO3的溶液中,通入0.5mol Cl2,发生反应:H2O+Cl2+2Na2CO3=NaCl+NaClO+2NaHCO3,次氯酸钠是强电解质,次氯酸根离子可以发生水解反应,碳酸氢钠中的碳酸氢根离子的水解程度大于电离程度,溶液显示碱性,据电荷守恒、物料守恒知识来回答.
解答 解:含1mol Na2CO3的溶液中,通入0.5mol Cl2,发生反应:H2O+Cl2+2Na2CO3=NaCl+NaClO+2NaHCO3,
A、反应后溶液的主要成分为NaCl、NaClO和NaHCO3,故A正确;
B、次氯酸钠中的次氯酸根离子可以发生水解反应,但是氯化钠不会水解,所以c(Cl-)>c(ClO-),故B错误;
C、在碳酸钠中存在物料守恒:c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)],但是该溶液中还存在氯化钠、次氯酸钠,故C错误;
D、根据电荷守恒:c(H+)+c(Na+)=c(OH-)+c(Cl-)+c(ClO-)+2c(CO32-)+c(HCO3-),故D错误.
故选A.
点评 本题考查学生溶液中离子浓度的大小关系知识,注意盐的水解原理的应用是解题的关键,难度中等.

练习册系列答案
相关题目
3.下列说法正确的是( )
| A. | 按系统命名法,化合物  的名称为2,4-二乙基-6-丙基辛烷 的名称为2,4-二乙基-6-丙基辛烷 | |
| B. | 月桂烯(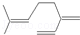 )所有碳原子一定在同一平面上 )所有碳原子一定在同一平面上 | |
| C. | 甲苯能使溴水和KMnO4溶液褪色 | |
| D. | HNO3能与苯、甲苯、甘油、纤维素等有机物发生重要反应,常用浓硫酸作催化剂 |
10.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 丙烯分子有7个σ键,1个π键 | |
| B. | 由2H和18O所组成的水11g,其中所含的中子数为4NA | |
| C. | 0.1mol SiO2晶体中所含有的硅氧键数目为0.2NA | |
| D. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3mol I2转移的电子数为5NA个 |
20.下列反应属于氧化还原反应的是( )
| A. | 二氧化碳和澄清石灰水反应 | B. | 实验室用双氧水制取氧气 | ||
| C. | 碳酸氢钠受热分解 | D. | 氧化铜和稀硫酸反应 |
7.下列现象与氢键有关的是( )
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
①NH3的熔、沸点比VA族其他元素氢化物的高
②乙醇、乙酸可以和水以任意比互溶
③冰的密度比液态水的密度小
④水分子高温下也很稳定.
| A. | ①②③④ | B. | ①②③ | C. | ①②④ | D. | ②③④ |
4.增塑剂DCHP可由环己醇制得.DCHP和环已醇的结构简式如图所示,下列说法错误的是( )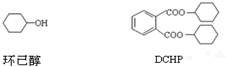

| A. | DCHP的分子式为C20H26O4 | |
| B. | 环己醇分子中所有碳原子不可能共平面 | |
| C. | DCHP的一氯取代物有5种 | |
| D. | DCHP通过取代反应可以得到环已醇 |

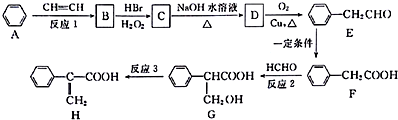
 .
.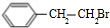 ;②D-E的化学方程式是2
;②D-E的化学方程式是2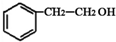 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2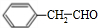 +2H2O;
+2H2O;
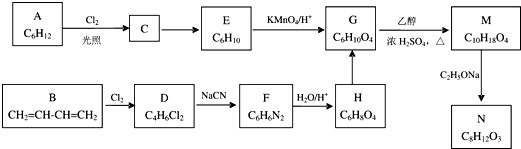
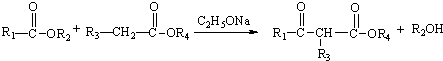
 .
.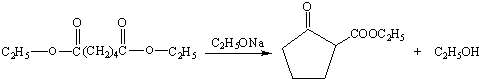 .
. .
.