题目内容
4.用催化剂可以使NO、CO污染同时降低,2NO(g)+2CO(g)?N2(g)+CO2(g),根据传感器记录某温度下NO、CO的反应进程,测量所得数据绘制出如图.前1s内的平均反应速率v(N2)=2.7×10-4mol/(L.s),第2s时的x值范围30.6>x>25.2.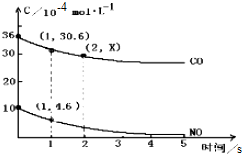
分析 利用v=$\frac{△c}{△t}$计算v(CO),根据速率之比等于化学计量数之比求v(N2),根据随着反应进行反应速率越来越小分析第2s时的x值范围.
解答 解:一氧化碳的反应速率为v(CO)=$\frac{△c}{△t}$=$\frac{(36-30.6)×1{0}^{\\;-4}mol/L}{1s}$=5.4×10-4mol/(L.s),同一化学反应同一时间段内,各物质的反应速率之比等于计量数之比,所以v(N2)=$\frac{1}{2}$v(CO)=2.7×10-4mol/(L.s);
因为随着反应进行反应速率越来越小,所以第2S消耗的CO小于第1S的36-30.6=5.4,则第2s时的30.6>x>30.6-5.4=25.2,
故答案为:2.7×10-4mol/(L.s);30.6>x>25.2.
点评 本题考查化学反应速率的计算和化学反应速率的影响因素,为高频考点,侧重于分析、理解能力及计算能力的考查,题目难度中等.

练习册系列答案
相关题目
14.下列各选项所述的两个量,前者一定大于后者的是( )
| A. | 同温下分别在100g水中最多能溶解的无水CuSO4和CuSO5•5H2O的质量 | |
| B. | 纯水在25℃和90℃时的pH值 | |
| C. | 25℃时,等体积的pH都等于3的盐酸和AlCl3溶液中,已电离的水分子数 | |
| D. | 在反应NH3+NO→N2+H2O中,被氧化和被还原的N原子数 |
15.X、Y、Z、W、M均为短周期元素,X、Y同主族,X的氢化物和最高价氧化物的水化物能反应生成一种离子化合物,其水溶液显酸性;Z、W、M是第3周期连续的三种元素,其中只有一种是非金属,且原子半径Z>W>M.下列叙述正确的是( )
| A. | M的单质能够用来制造光导纤维 | |
| B. | Z、W、M的氧化物均可做耐高温材料 | |
| C. | 工业上常用电解熔融氯化物的方法制备Z、W的单质 | |
| D. | Y的单质都有剧毒,而且其着火点低,常保存在冷水中 |
12.部分物质的熔点数据如下表:
下列说法正确的是( )
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
| A. | 金属晶体的熔点不一定比分子晶体的高 | |
| B. | 表中共价化合物分子的所有原子都形成了8电子结构 | |
| C. | 同族元素的氧化物形成的晶体类型一定相同 | |
| D. | AlF3、AlCl3、BCl3都是离子化合物 |
19.化学与社会、科学、技术、环境等有密切关系.下列说法不正确的是( )
| A. | 司母戊鼎、定远舰甲板、有机玻璃等原材料属于合金 | |
| B. | 氯气是塑料、合成橡胶、合成纤维、农药、染料及药品的重要原料 | |
| C. | 工业上生产玻璃、水泥、漂白粉均需要用石灰石为原料 | |
| D. | 用浸泡过溴的四氯化碳溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的 |
16.近年来,我国多地频现种种极端天气,二氧化碳、氮氧化物、二氧化硫是导致极端天气的重要因素.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
①结合上表数据,写出NO与活性炭反应的化学方程式C+2NO?N2+CO2;
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
(1)活性炭可用于处理大气污染物NO,在1L恒容密闭容器中加入0.100mol NO和2.030mol固体活性炭(无杂质),生成气体E和气体F.当温度分别在T1℃和T2℃时,测得平衡时各物质的物质的量如下表:
 | 活性炭 | NO | E | F |
| T1 | 2.000 | 0.040 | 0.030 | 0.030 |
| T2 | 2.005 | 0.050 | 0.025 | 0.025 |
②上述反应的平衡常数表达式K=$\frac{c({N}_{2})c(C{O}_{2})}{{c}^{2}(NO)}$,根据上述信息判断,T1和T2的关系是C;
A.T1>T2B.T1<T2C.无法比较
③在T1℃下反应达到平衡后,下列措施能改变NO的转化率的是cd;
a.增大c(NO) b.增大压强 c.升高温度 d.移去部分F
(2)碘循环工艺不仅能吸收SO2降低环境污染,同时又能制得H2,具体流程如图1所示

①用离子方程式表示反应器中发生的反应SO2+I2+2H2O=SO42-+2I-+4H+;
②用化学平衡移动的原理分析,在HI分解反应中使用膜反应器分离出H2的目的是HI分解为可逆反应,及时分离出产物H2,有利于反应正向进行;
(3)开发新能源是解决大气污染的有效途径之一.直接甲醇燃料电池(简称DMFC)由于结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注.DMFC工作原理如图2所示
通过a气体的电极是原电池的负极(填“正”或“负”),b电极反应式为O2+4e-+4H+=2H2O.
13.20mL0.05mol/L含有Cr2O72-离子的浓溶液恰好能将20mL0.3mol/L的Fe2+溶液完全氧化,则元素Cr在还原产物中的化合价为( )
| A. | +3价 | B. | +6价 | C. | +4价 | D. | +5价 |