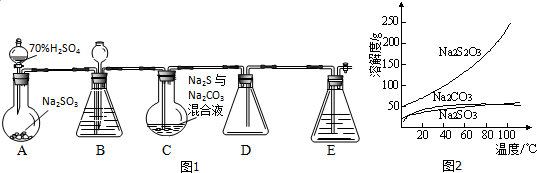
题目内容
5.H2在工农业生产过程中有着重要的作用.(1)工业上用电解饱和食盐水的方法制取H2,该反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑
(2)如图1是为LiBH4/MgH2体系放氢焓变示意图,
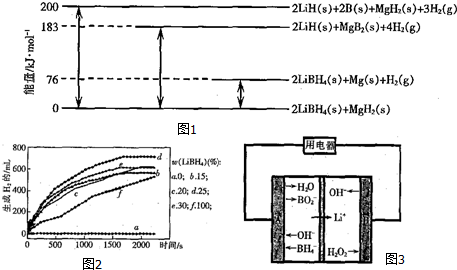
则由LiH、B与H2反应得到LiBH4的热化学方程式为2LiH(s)+2B(s)+3H2(g)═2LiBH4(s)△H=-200kJ•mol-1.
(3)图2为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图.下列说法正确的是ABC(填字母).
A.25℃,无LiBH4时,Al与水不反应
B.25℃,纯LiBH4与水反应产生氢气
C.25℃,Al-LiBH4复合材料与水反应时,Al也参与了反应
D.25℃,Al-LiBH4复合材料中LiBH4含量越高,反应得到氢气越多
(4)图3是LiBH4-H2O2-LiOH燃料电池示意图.A、B皆为惰性电极,左右池间有阳离子交换膜.该电池工作时,正极附近溶液的[OH-]增大.(填“增大”、“减小”或“不变”),负极的电极反应式为BH4--8e-+8OH-═BO2-+6H2O.外电路中每通过1mol 电子,将消耗17g过氧化氢.
分析 (1)工业用电解饱和食盐水的方法制取NaOH,同时生成H2和Cl2;
(2)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①,据此反应得到;
(3)A.因为由图LiBH4含量为0时,氢气的体积为0,故25℃时,纯铝与水不反应,;
B.负一价的氢与正一价的氢发生归中反应生成氢气,LiBH4+4H2O=LiB(OH)4+4H2↑;
C.图象可知f是纯净LiBH4,bcd是每克不同配比的Al-LiBH4复合材料生成氢气变化,据此分析;
D.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小;
(4)如图3正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,溶液的pH增大,负极发生还原反应,注意是碱性介质,结合电极反应和电子守恒计算消耗过氧化氢质量.
解答 解:(1)工业用电解饱和食盐水的方法制取NaOH,同时生成H2和Cl2,化学方程式为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑,
故答案为:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑;
(2)由图可知:2LiBH4(s)+MgH2(s)=2LiH(s)+2B(s)+MgH2(s)+3H2(g)△H=+200 kJ•mol-1①
2LiBH4(s)+MgH2(s)=2LiBH4(s)+Mg(s))+H2(g)△H=+76 kJ•mol-1②
2LiBH4(s)+MgH2(s)=2LiH(s)+MgB2(s)+4H2(g)△H=+183 kJ•mol-1③
依据①得到2LiH(s)+2B(s)+3H2(g)═2LiBH4(s)△H=-200kJ•mol-1,
故答案为:2LiH(s)+2B(s)+3H2(g)═2LiBH4(s)△H=-200kJ•mol-1;
(3)A.25℃时,纯铝与水不反应,因为由图LiBH4含量为0时,氢气的体积为0,故A选;
B.25℃时,纯LiBH4与水反应产生氢气,负一价的氢与正一价的氢发生归中反应生成氢气,故B选;
C.图象可知f是纯净LiBH4,bcd是每克不同配比的Al-LiBH4复合材料生成氢气变化量可知比纯净LiBH4放出氢气多说明氯参加反应,故C正确;
D.由图可知25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越小,故D不选;
故答案为:ABC;
(4)如图3正极是阳离子流向的一极,即过氧化钠所在的一极,发生还原反应,负一价的氧得电子生成氧负离子,跟水结合成氢氧根离子,为:H2O2+2e-=2OH-,电极反应溶液的pH增大,负极发生还原反应,注意是碱性介质,电极反应式为:BH4--8e-+8OH-═BO2-+6H2O,外电路中每通过1mol 电子消耗过氧化氢0.5mol,质量=0.5mol×34g/mol=17g,
故答案为:增大;BH4--8e-+8OH-═BO2-+6H2O;17;
点评 本题考查元素化合物知识,涉及热化学方程式的书写,盖斯定律的应用,电化学知识,主要是图象变化的特征分析判断,综合性非常强,题目难度中等.

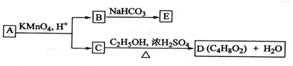
| A. | B的结构简式为HOOC-CH2-COOH | |
| B. | C与乙醇发生了酯化反应 | |
| C. | A的结构简式是CH3-CH(OH)-CH=CH-CH3 | |
| D. | E的分子式为C3H2O4Na2 |
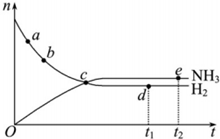 对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )
对于体积不变密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),673K,30MPa下n(NH3)和n(H2)随时间变化的关系如图所示.下列叙述正确的是( )| A. | a点、b点的正反应速率比逆反应速率大 | |
| B. | c点时每断裂3molH-H则断裂6molN-H | |
| C. | d点(t1时刻)和点e(t2时刻)处n(N2)不一样 | |
| D. | v(N2):V (NH3)=1:2时达到平衡 |
| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
| A. | CaCl2和Na2O2 | B. | NaOH和CCl4 | C. | CO2和MgCl2 | D. | NaOH和NaClO |
| A. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA | |
| B. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| C. | 0.1molFe与0.1mol氯气反应时失去的电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子 |
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
| A. | X能形成化学式为H2XO4的酸 | |
| B. | X能与某些金属元素形成化合物 | |
| C. | X原子的最外层电子数和核电荷数肯定为奇数 | |
| D. | X可能形成化学式为KXO3的盐 |