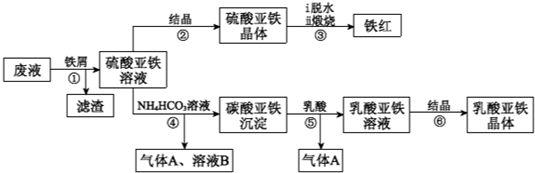
题目内容
10.实验室用如图1的装置模拟工业过程制取硫代硫酸钠(夹持仪器和加热仪器均省略).其反应原理为2Na2S+Na2CO3+4SO2$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3+CO2.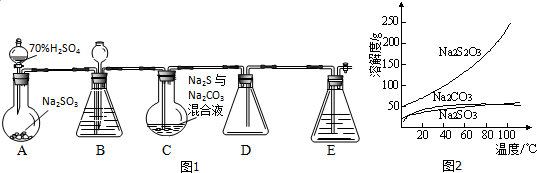
(1)A中盛放70%H2SO4的仪器的名称为分液漏斗.
(2)仪器组装完成后,关闭两端活塞,向装置中的长颈漏斗内注入一定量的液体,其目的是检查装置气密性.
(3)打开分液漏斗活塞,注入浓硫酸,片刻后加热装置C,反应后可得Na2S2O3溶液.该溶液中主要含有Na2CO3、Na2SO3两种杂质,其有关物质的溶解度曲线如图2所示.
①C装置中生成Na2SO3的化学方程式为Na2CO3+SO2=Na2SO3+CO2.
②根据溶解度曲线,请补充从C装置的混合溶液中制得Na2S2O3的操作步骤:蒸发浓缩;降温结晶;过滤、洗涤、干燥.
(4)为测定产品的纯度,称取2.0g该产品于锥形瓶中加水溶解;另取一定体积0.1mol/L 酸性K2Cr2O7溶液,
向其中加入过量的KI晶体(已知:Cr2O72-被还原成Cr3+,方程式为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O),
并滴加几滴淀粉溶液,溶液呈蓝色(溶液体积变化忽略不计);用该蓝色溶液滴定上述所配Na2S2O3溶液
(发生反应为I2+2S2O32-=2I-+S4O62-),消耗蓝色溶液20.00mL.计算该产品的纯度(写出计算过程).
分析 (1)根据装置图可知仪器名称;
(2)由于本装置中有气体参加,所以实验前要检验装置的气密性;
(3)①二氧化硫与碳酸钠反应可生成亚硫酸钠;
②Na2S2O3中主要含有Na2CO3、Na2SO3两种杂质,根据溶解度曲线,Na2CO3、Na2SO3溶解度受温度影响较小,而Na2S2O3受温度影响较大,据此答题;
(4)K2Cr2O7的物质的量为0.1mol/L×0.02L=0.002mol,根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O可知,I2的物质的量为0.006mol,根据反应I2+2S2O32-=2I-+S4O62-,可知Na2S2O3的物质的量为0.012mol,据此计算该产品的纯度;
解答 解:(1)根据装置图可知A中盛放70%H2SO4的仪器的名称为分液漏斗,
故答案为:分液漏斗;
(2)由于本装置中有气体参加,所以实验前要检验装置的气密性,所以向装置中的长颈漏斗内注入一定量的液体,其目的是检查装置气密性,
故答案为:检查装置气密性;
(3)①二氧化硫与碳酸钠反应可生成亚硫酸钠,反应的方程式为Na2CO3+SO2=Na2SO3+CO2,
故答案为:Na2CO3+SO2=Na2SO3+CO2;
②Na2S2O3中主要含有Na2CO3、Na2SO3两种杂质,根据溶解度曲线,Na2CO3、Na2SO3溶解度受温度影响较小,而Na2S2O3受温度影响较大,所以从混合溶液中制得Na2S2O3的操作步骤为蒸发浓缩、降温结晶、过滤、洗涤、干燥,
故答案为:蒸发浓缩、降温结晶;
(4)K2Cr2O7的物质的量为0.1mol/L×0.02L=0.002mol,根据反应Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O可知,I2的物质的量为0.006mol,根据反应I2+2S2O32-=2I-+S4O62-,可知Na2S2O3的物质的量为0.012mol,所以2.0g产品含有Na2S2O3的质量为0.012mol×158g/mol=0.1896g,所以产品的纯度为$\frac{0.1896g}{2g}$×100%=94.8%,
答:该产品的纯度为94.8%.
点评 本题考查了实验基本操作、氧化还原反应的计算等,题目难度中等,为高频考点,侧重于学生的分析能力和计算能力的考查,注意守恒思想在氧化还原反应计算中应用.

| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
| A. | ${\;}_{1}^{1}$H2、${\;}_{1}^{2}$H2、${\;}_{1}^{3}$H2 | B. | ${\;}_{6}^{12}$C、${\;}_{6}^{14}$C | ||
| C. | D2O、H2O | D. | 金刚石、石墨 |

 .
.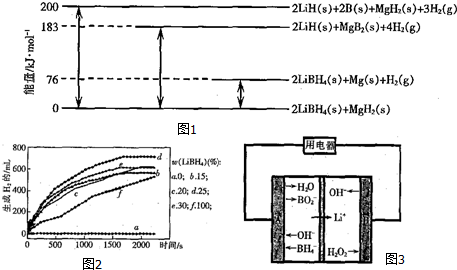
 化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答:
化学材料的研发和使用,为开发太阳能资源,寻求经济发展的新动力提供有力支撑,请根据你所学知识回答: