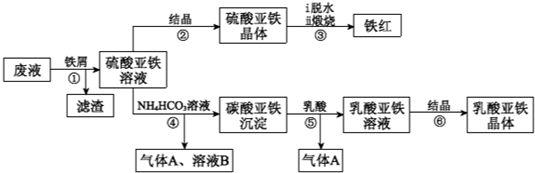
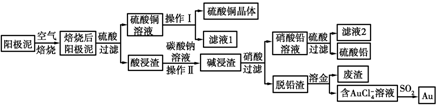
题目内容
17.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA | |
| B. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| C. | 0.1molFe与0.1mol氯气反应时失去的电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子 |
分析 A、CO2和N2O的摩尔质量均为44g/mol;
B、标况下己烷为液态;
C、0.1mol铁和0.1mol氯气反应时,铁过量,根据氯气反应后变为-1价来分析;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属.
解答 解:A、CO2和N2O的摩尔质量均为44g/mol,故4.4g混合物的物质的量为0.1mol,而两者均为三原子分子,故0.1mol混合物中含0.3NA个原子,故A正确;
B、标况下己烷为液态,故不能根据气体摩尔体积来计算其物质的量和共用电子对数,故B错误;
C、0.1mol铁和0.1mol氯气反应时,铁过量,根据氯气反应后变为-1价,故0.1mol氯气反应后转移0.2NA个电子,故C错误;
D、电解精炼铜时,阳极上放电的不止是铜,还有比铜活泼的金属,故当阳极质量减少32g时,转移电子数大于NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
7.常温下,下列各组离子在指定溶液中能大量共存的是( )
| A. | FeCl3溶液中:K+、OH-、SO42-、SCN- | |
| B. | 使酚酞试液变红的溶液中:NH4+、Na+、HCO3-、NO3- | |
| C. | c(OH-)=1mol/L的溶液中:Na+、K+、CO32-、NO3- | |
| D. | c(H+)=1mol/L的溶液中:K+、Na+、Fe2+、NO3- |
8.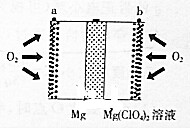 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )| A. | 放电时Mg在负极被ClO4-氧化 | |
| B. | 正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| D. | 理论上外电路流过1mol电子时电池总质量增加8.0g |
6.下列工业废气经过处理后可作为燃料的是( )
| A. | 高炉煤气 | B. | 硫酸工业废气 | C. | 炼油厂气 | D. | 硝酸工业废气 |
7.3.2g铜与过量的硝酸(8mol•L-1,60mL)充分反应后,硝酸的还原产物有NO、NO2,反应后溶液中所含H+离子为nmol.此时溶液中所含NO3-的物质的量为( )
| A. | 0.28mol | B. | 0.3lmol | C. | (n+0.2)mol | D. | (n+0.1)mol |
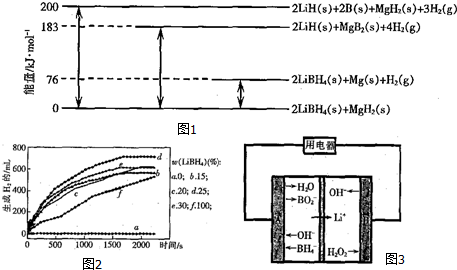
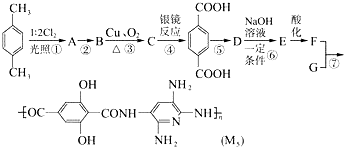
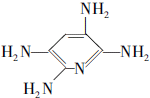 ,F的含氧官能团的名称有羧基、(酚)羟基.
,F的含氧官能团的名称有羧基、(酚)羟基.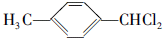 .
.