题目内容
13.下列离子方程式书写不正确的是( )| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
分析 A.碳酸氢钠溶液与少量氢氧化钙溶液混合,氢氧化钙完全反应,生成碳酸钙和碳酸钠;
B.用石墨做电极电解硫酸铜溶液,阳极生成氧气,阴极生成铜,且生成硫酸;
C.亚铁离子的还原性大于溴离子,氯气不足时亚铁离子优先反应;
D.向硫酸铝溶液中加入过量的氨水,只生成氢氧化铝沉淀.
解答 解:A.碳酸氢钠溶液与少量氢氧化钙溶液混合,氢氧化钙完全反应,离子方程式为2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32-,故A正确;
B.用石墨做电极电解硫酸铜溶液,阳极生成氧气,阴极生成铜,且生成硫酸,反应的离子方程式为2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+,故B正确;
C.向FeBr2中通入等量Cl2,亚铁离子优先反应,然后部分溴离子被氯气氧化,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+2Cl-,故C正确;
D.硫酸铝溶液中加入过量的氨水,氢氧化铝不溶于氨水,正确的离子方程式为:Al3++3NH3•H2O═3NH4++Al(OH)3↓,故D错误.
故选D.
点评 本题考查了离子方程式书写,为高频考点和常见题型,题目难度中等,明确发生反应的实质为解答关键,注意熟练掌握离子方程式的书写原则,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
3.下列说法中正确的是( )
| A. | 周期表中所有的族都是由长、短周期的元素共同组成 | |
| B. | 最外层电子数相同的元素不一定都是同一族 | |
| C. | 非金属元素都是主族元素,金属元素都是副族元素 | |
| D. | 元素周期表中共有18个纵行,每个纵行都是一个族,共有18个族 |
4.在锌与某浓度的盐酸反应的实验中,实验员得到下面的结果:
(1)写出实验中发生反应的离子方程式:Zn+2H+=Zn2++H2↑,该反应是放热反应(填“放热”或“吸热”);
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要比块状时的接触面大得多.
| 锌的质量(g) | 锌的形状 | 温度(℃) | 溶解于酸花的时间(s) | |
| A | 2 | 薄片 | 5 | 400 |
| B | 2 | 薄片 | 15 | 200 |
| C | 2 | 薄片 | 25 | 100 |
| D | 2 | 薄片 | 35 | 50 |
| E | 2 | 薄片 | 45 | 25 |
| F | 2 | 粉末 | 15 | 5 |
(2)仔细观察A~F的实验数据对比,你可以得到关于温度影响反应速率结论,用此结论,计算:55℃时,2g锌薄片溶解于酸中需花12.5 s.
(3)对比结果B与F,解释结果F那么快的原因:B中锌是块状,F中锌是粉末状,粉末状时锌与酸溶液的接触面要比块状时的接触面大得多.
1.在相同温度下等体积等物质的量浓度的4种稀溶液:①H2SO4 ②H2SO3 ③NaHSO3 ④Na2CO3中含带电微粒数由多到少的顺序是( )
| A. | ④>①>③>② | B. | ④=①>③>② | C. | ①>④>③>② | D. | ①=④>③=② |
8.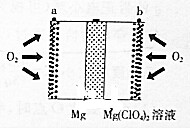 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
 镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )
镁空气电池具有比锂电池更好的安全性和更低的成本,主要用于备用电源、军事应用,其工作原理如图所示.下列说法错误的是( )| A. | 放电时Mg在负极被ClO4-氧化 | |
| B. | 正极的电极反应为:O2+2H2O+4e-═4OH- | |
| C. | 电池总反应为2Mg+O2+2H2O═2Mg(OH)2 | |
| D. | 理论上外电路流过1mol电子时电池总质量增加8.0g |

 .
.