题目内容
18.下列说法中,不能用元素周期律解释的是( )| A. | 向淀粉KI溶液中滴入溴水,溶液变蓝 | |
| B. | 与冷水反应的速率:Na>Mg | |
| C. | 浓硝酸的氧化性强于稀硝酸 | |
| D. | 原子半径:Al>Si>P |
分析 A.非金属性强的元素单质,能从非金属性弱的非金属盐中置换出该非金属单质;
B.金属与水反应速率的快慢可以表明该金属的活动性;
C.硝酸的浓度越大,其氧化性越强;
D.同一周期,原子序数越大,半径越小.
解答 解:A.向淀粉KI溶液中滴入溴水,溶液变蓝,说明溴单质的氧化性强于碘单质,能用元素周期律解释,故A正确;
B.与冷水反应的速率:Na>Mg,说明金属性Na>Mg,同一周期,随着原子序数的递增,金属性减弱,故能用元素周期律解释,故B正确;
C.硝酸的浓度越大,其氧化性越强,与元素周期无关,故不能用元素周期律解释,故C错误;
D.同一周期,原子序数越大,半径越小,能用元素周期律解释,故D正确,故选C.
点评 本题侧重于元素周期律的理解与应用的考查,注意把握元素周期律的递变规律以及相关知识的积累,难度不大

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
10.向1L 1mol/L AlCl3溶液中滴加一定量的NaOH溶液,若产生沉淀为0.8mol,则消耗的NaOH的物质的量可能是( )
| A. | 0.8 mol | B. | 2.8 mol | C. | 3.2 mol | D. | 3.8 mol |
9.分子式为C8H10的芳香烃有( )种.
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
6.镁镍蓄电池放电时的总反应为Mg+Ni2O3+3H2O═Mg(OH)2+2Ni(OH)2.下列有关该电池的说法不正确的是( )
| A. | 电池的电解液为碱性溶液,正极为Ni2O3、负极为Mg | |
| B. | 电池放电时,负极反应为Mg+2OH--2e-═Mg(OH)2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-═Ni2O3+3H2O |
13.1molRO4-能氧化5mol的Fe2+,则在还原产物中R元素的化合价( )
| A. | +2 | B. | +3 | C. | +4 | D. | +5 |
10.X、Y、Z、W是原子序数依次增大的4种短周期元素.X与Z位于同一主族,X原子的最外层电子数是次外层电子数的2倍,Y元素的单质既能与盐酸反应又能与NaOH溶液反应,X、Y、Z、W原子的最外层电子数之和为18.下列说法不正确的是( )
| A. | X单质在一定条件下能与Z的最高价氧化物发生置换反应 | |
| B. | 原子半径:Y>Z>W | |
| C. | 最高价氧化物对应水化物的酸性由弱到强的顺序:X<Z<W | |
| D. | 室温下,0.1mol/LW的气态氢化物的水溶液的pH=1 |
6.下列有机化合物中,可以看作醇类的是( )
| A. |  | B. |  | ||
| C. |  | D. |  |
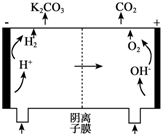 为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).
为实现CO2减排,热钾碱法化学吸收CO2在合成氨、制氢、天然气等石油化工行业中应用广泛.该方法的原理是用碳酸钾溶液吸收CO2生成碳酸氢钾(称富液)来脱除CO2.之后高温加热富液,使碳酸氢钾分解释放CO2生成碳酸钾,溶液循环使用.某研究小组用500mL 1mol/L K2CO3溶液吸收5.6L 的CO2(标准状况)形成富液(忽略溶液体积变化).