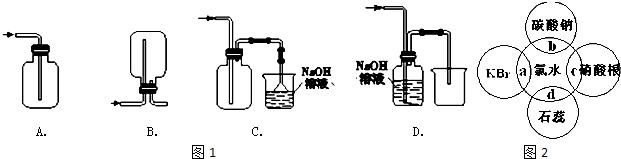
题目内容
11.氧化还原反应在生产、生活中具有广泛的用途.下列做法中涉及到铝元素的还原性的( )| A. | 明矾净化水 | B. | 用氢氧化铝治疗胃酸过多 | ||
| C. | 用铝制容器存放浓硫酸 | D. | 电解熔融氧化铝制单质铝 |
分析 涉及铝元素还原性,Al元素化合价应升高,在反应中被氧化,以此解答该题.
解答 解:A.为水解反应,元素化合价没有发生变化,不是氧化还原反应,故A错误;
B.为复分解反应,元素化合价没有发生变化,不是氧化还原反应,故B错误;
C.用铝制容器存放浓硫酸,发生钝化反应,铝被氧化生成氧化铝,铝表现还原性,故C正确;
D.电解熔融氧化铝制单质铝,铝元素化合价降低,被还原,表现氧化性,故D错误.
故选C.
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,题目难度不大.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
1.有两种烃,甲为 ,乙为
,乙为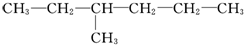 .下列有关它们命名的说法正确的是( )
.下列有关它们命名的说法正确的是( )
 ,乙为
,乙为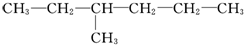 .下列有关它们命名的说法正确的是( )
.下列有关它们命名的说法正确的是( )| A. | 甲、乙的主链碳原子数都是6个 | B. | 甲、乙的主链碳原子数都是5个 | ||
| C. | 甲的名称为2-丙基-1-丁烯 | D. | 乙的名称为3-甲基己烷 |
2.下列反应的离子方程式书写正确的是( )
| A. | 用小苏打治疗胃酸过多:CO3-+2H+═CO2↑+H2O | |
| B. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| C. | 硫酸铜溶液中加入过量铁粉:Cu2++2Fe═2Fe3++Cu | |
| D. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO${\;}_{2}^{-}$+H2O |
3.NA表示阿伏加德罗常数,下列叙述正确的是( )
| A. | 电解精炼铜的过程中,每转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol烃基与17gNH3所含电子数之比为9:10 | |
| D. | 一定温度下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl含NH4+的物质的量相同 |
20.下列物质中,不能使酚酞溶液变红的是( )
| A. | NH3 | B. | Na2SiO3 | C. | NaHCO3 | D. | Al(OH)3 |
6.NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| C. | 2L0.5mol/L亚硫酸溶液中含有的氢离子数为2NA | |
| D. | 密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA |