题目内容
18.(1)某温度下纯水中c(H+)=2×10-7 mol/L,则c(OH-)=2×10-7mol/L,若温度不变,滴入稀盐酸使c(H+)=5×10-6 mol/L,则此时溶液中的c(OH-)=8×10-9mol/L.(2)用物质的量浓度为0.04mol/L的氢氧化钠溶液去中和H+浓度为10-3mol/L的某一元弱酸溶液20mL,消耗氢氧化钠溶液12.5mL,则此一元弱酸物质的量浓度为0.025mol/L;电离度为4%.
(3)25℃时,在0.5L0.2mol/L的HA溶液中,有0.01mol的HA电离成离子,则该温度下的电离常数为2.2×10-3.
分析 (1)根据纯水显中性来解答;在酸溶液、碱溶液、盐溶液中存在离子积常数,Kw只随温度变化;依据离子积计算离子浓度;
(2)NaOH溶液滴定H+浓度为10-3mol/L的一元弱酸HA的溶液20mL,达到终点时消耗NaOH溶液12.5mL,利用c酸V酸=c碱V碱计算;H+浓度为10-3mol/L的某一元弱酸中c(H+)=c(A-)=c(HA)电离=10-3mol/L,进而计算一元弱酸的电离度;
(3)根据HA电离出来的离子的量求出其浓度,再根据电离平衡常数K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$计算.
解答 解:(1)某温度下纯水中的c(H+)=2×10-7mol/L,根据纯水显中性,则此时溶液中的c(OH-)=2×10-7mol/L;Kw只随温度变化,若温度不变,Kw不变,即Kw=c(H+)×c(OH-)=4×10-14,滴入稀盐酸,使c(H+)=5×10-6mol/L,则c(OH-)=8×10-9mol/L,
故答案为:2×10-7mol/L;8×10-9mol/L;
(2)NaOH溶液滴定H+浓度为10-3mol/L的一元弱酸HA的溶液20mL,达到终点时消耗NaOH溶液12.5mL,由c酸V酸=c碱V碱可知,12.5×10-3L×0.04mol/L=c酸×20×10-3L,解得:c酸=0.025mol/L;
H+浓度为10-3mol/L的某一元弱酸中c(H+)=c(A-)=c(HA)电离=10-3mol/L,一元弱酸的电离度为:$\frac{c(HA)_{电离}}{c(HA)}$×100%=$\frac{1{0}^{-3}}{0.025}$×100%=4%,
故答案为:0.025mol/L;4%;
(3)在0.5L0.2mol.L-1的HA溶液中,有0.01mol的HA电离成离子,即c(A-)=c(H+)=$\frac{0.01mol}{0.5L}$=0.02mol.L-1,则K=$\frac{c({H}^{+})•c({A}^{-})}{c(HA)}$≈2.2×10-3,
故答案为:2.2×10-3.
点评 本题考查了溶液pH的计算、弱电解质的电离平衡及其影响,题目难度中等,明确溶液酸碱性与溶液pH的关系为解答关键,注意掌握影响弱电解质的电离平衡的因素,试题培养了学生的分析能力及化学计算能力.

| A. | 重金属离子可导致蛋白质盐析 | |
| B. | 芳香烃就是苯和苯的同系物 | |
| C. | SO2和NxOy都属于酸性氧化物 | |
| D. | 汽车尾气的大量排放是造成雾霾天气的人为因素之一 |
| A. | 水、硝酸银溶液、稀硝酸 | B. | 水、氢氧化钠溶液、盐酸 | ||
| C. | 水、氢氧化钾溶液、盐酸 | D. | 水、氢氧化钾溶液、硫酸 |
| A. | 电解氯化钠溶液制金属钠 | B. | 石灰石是炼铁和制玻璃的原料之一 | ||
| C. | 氯气通入石灰乳中制漂白粉 | D. | 工业炼铁的主要设备高炉 |
| A. | 若将四种溶液稀释100倍,溶液pH大小顺序:③>④>①>② | |
| B. | ③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③=④ | |
| C. | ①与②分别与足量镁粉反应,生成H2的量:①<② | |
| D. | ②和③混合,所得混合溶液的pH大于7 |
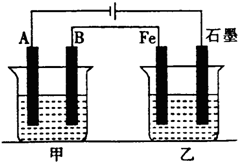 如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答:
如图所示,甲、乙为相互串联的两电解池,甲池利用电解原理在铁上镀银,一段时间后,甲池阴极增重43.2g,乙中盛放足量的CuSO4溶液,请回答: