题目内容
13.以乙烯为原料合成化合物C的流程如图所示: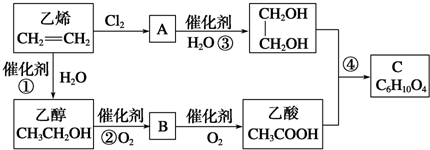
(1)B中含有的官能团名称为醛基.
(2)写出A的结构简式:ClCH2CH2Cl.
(3)①、④的反应类型分别为加成反应、酯化或取代反应.
(4)写出反应②和④的化学方程式:
②2CH3CH2OH+O2$\underset{\stackrel{Cu}{→}}{△}$2CH3CHO+2H2O;
④2CH3COOH+HOCH2CH2OH
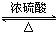
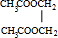 +2H2O.
+2H2O.
分析 乙烯与氯气发生加成反应生成A为ClCH2CH2Cl,A氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知C为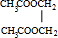 ,据此解答.
,据此解答.
解答 解:乙烯与氯气发生加成反应生成A为ClCH2CH2Cl,A氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知C为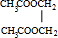 .
.
(1)B为CH3CHO,含有醛基,故答案为:醛基;
(2)由上述分析可知,A的结构简式为:ClCH2CH2Cl,故答案为:ClCH2CH2Cl;
(3)反应①是乙烯与水发生加成反应生成乙醇,
反应④是乙酸与乙二醇发生酯化反应,也属于取代反应,
故答案为:加成;酯化或取代;
(4)反应②是乙醇发生催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$\underset{\stackrel{Cu}{→}}{△}$2CH3CHO+2H2O,
反应④是乙酸与乙二醇发生酯化反应生成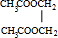 ,反应方程式为:2CH3COOH+HOCH2CH2OH
,反应方程式为:2CH3COOH+HOCH2CH2OH
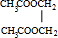 +2H2O,
+2H2O,
故答案为:2CH3CH2OH+O2$\underset{\stackrel{Cu}{→}}{△}$2CH3CHO+2H2O;2CH3COOH+HOCH2CH2OH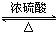
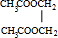 +2H2O.
+2H2O.
点评 本题考查有机物的推断与合成、官能团、有机反应类型、方程式书写等,涉及烯烃、醇、醛、羧酸、卤代烃性质,掌握官能团的性质是解题的关键,难度不大.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
3.配制100mL 1mol/L 的 NaCl溶液的过程中,肯定不需用到的仪器是( )
| A. | 容量瓶 | B. | 胶头滴管 | C. | 烧瓶 | D. | 玻璃棒 |
4.以下除杂方案不正确的是( )
| A. | Cl2中混有HCl,可依次通入盛有饱和食盐水、浓H2SO4的洗气瓶 | |
| B. | NH4Cl 溶液中混有Fe3+,可加入NaOH溶液后过滤 | |
| C. | CO中混有CO2,可依次通入盛NaOH 溶液、浓 H2SO4的洗气瓶 | |
| D. | Na2CO3固体中混有NaHCO3,可用灼烧的方法除尽 |
18.Na3N是离子化合物,它和水作用可产生NH3.下列叙述正确的是( )
| A. | Na3N与盐酸反应生成的都是盐 | |
| B. | Na+和N3-的电子层结构不相同 | |
| C. | Na+的半径大于N3-的半径 | |
| D. | 在Na3N与水的反应中,Na3N做还原剂 |
2.某物质的产量能用来衡量一个国家石油化工发展水平,该物质是( )
| A. | 苯 | B. | 甲烷 | C. | 乙烯 | D. | 乙醇 |
3.目前世界上 60%的镁是从海水中提取的.学生就这个课题展开了讨论.已知海水提镁的主要步骤如图:
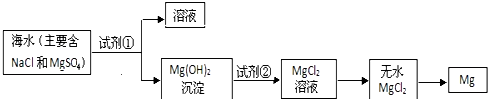
(一)在海水提镁的过程中如何实现对镁离子的富集?学生提出三个不同观点.
观点 1:直接往海水中加入沉淀剂.
观点 2:高温加热蒸发海水后,再加入沉淀剂.
观点 3:利用晒盐后的苦卤水,再加入沉淀剂.
请你评价三个学生提出的观点是否正确(填是或否),并简述理由.
(二)在海水提镁的过程中如何实现对镁离子的分离?
(1)为了使镁离子沉淀下来,加入的足量试剂①是Ca(OH)2(填化学式).
(2)加入的足量试剂②是HCl(填化学式).
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是c.
a.Mg(OH)2$\stackrel{△}{→}$MgO$→_{2800℃}^{电解}$Mg b.Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{C}{→}$Mg
c.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{714℃}^{电解}$Mg d.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{还原}^{活泼金属}$Mg.

(一)在海水提镁的过程中如何实现对镁离子的富集?学生提出三个不同观点.
观点 1:直接往海水中加入沉淀剂.
观点 2:高温加热蒸发海水后,再加入沉淀剂.
观点 3:利用晒盐后的苦卤水,再加入沉淀剂.
请你评价三个学生提出的观点是否正确(填是或否),并简述理由.
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
(1)为了使镁离子沉淀下来,加入的足量试剂①是Ca(OH)2(填化学式).
(2)加入的足量试剂②是HCl(填化学式).
(3)试从节约能源,提高金属镁的纯度分析,以下适宜的冶镁方法是c.
a.Mg(OH)2$\stackrel{△}{→}$MgO$→_{2800℃}^{电解}$Mg b.Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{C}{→}$Mg
c.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{714℃}^{电解}$Mg d.Mg(OH)2$\stackrel{HCl}{→}$MgCl2$→_{还原}^{活泼金属}$Mg.
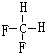 和
和
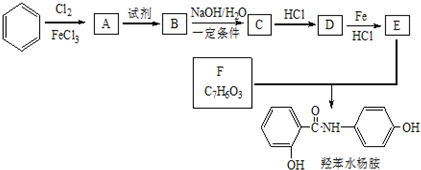
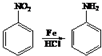
 +2NaOH$→_{一定条件}^{水}$
+2NaOH$→_{一定条件}^{水}$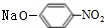 +NaCl+H2O.
+NaCl+H2O.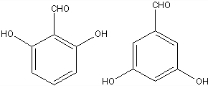 、
、 (任意一种).
(任意一种).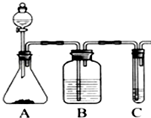 利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.
利用如图装置还可以验证醋酸、苯酚、碳酸的酸性强弱.